Способы защиты металлов от химической коррозии
Так как химическая коррозия никоим образом не связана с потенциалом металла, и протекторы либо катоды ее не предотвратят, способы защиты от нее имеют свою специфику. Борьба с разрушением такого характера может проходить по трем основным направлениям:
- Метод конструкционного решения проблемы. Он связан с тем, чтобы использовать сплавы, которые имеют очень высокую устойчивость к коррозии, либо применять биметаллические композиции, где основной конструкционный металл покрыт тонким слоем устойчивого соединения (например, оцинковку).
- Метод улучшения среды, где будет эксплуатироваться изделие, путем изменения pH, нейтрализации агрессивных составляющих коррозионной среды.
- Метод пассивной защиты, наиболее известный тем, что доступ к поверхности конструкции в коррозионной среде блокируется пленкой из неактивного и не вступающего в реакцию материала. Это покрытие разного рода лакокрасочными компонентами для защиты от коррозии.
Есть ли надежда?
Ущерб, наносимый человечеству коррозией, колоссален. По разным данным коррозия «съедает» от 10 до 25% мировой добычи железа. Превращаясь в бурый порошок, оно безвозвратно рассеивается по белу свету, в результате чего не только мы, но и наши потомки остаемся без этого ценнейшего материала.
Но беда не только в том, что теряется металл как таковой, нет — разрушаются мосты, машины, крыши, памятники архитектуры. Коррозия не щадит ничего.
Неизлечимо больна та же Эйфелева башня — символ Парижа. Изготовленная из обычной стали, она неизбежно ржавеет и разрушается. Башню приходится красить каждые 7 лет, отчего ее масса каждый раз увеличивается на 60-70 тонн.

К сожалению, полностью предотвратить коррозию металлов невозможно. Ну, разве что полностью изолировать металл от окружающей среды, например поместить в вакуум. Но какой смысл от таких «консервированных» деталей? Металл должен работать. Поэтому единственным способом защиты от коррозии является поиск путей ее замедления.
В незапамятные времена для этого применяли жир, масла, позднее начали покрывать железо другими металлами. Прежде всего, легкоплавким оловом. В трудах древнегреческого историка Геродота (V в. до н.э.) и римского ученого Плиния-старшего уже есть упоминания о применении олова для защиты железа от коррозии.
Интересный случай произошел в 1965 году на Международном симпозиуме по борьбе с коррозией. Некий индийский ученый рассказал об обществе по борьбе с коррозией, которое существует около 1600 лет и членом которого он является. Так вот, полторы тысячи лет назад это общество принимало участие в постройке храмов Солнца на побережье у Конарака. И несмотря на то, что эти храмы некоторое время были затоплены морем, железные балки прекрасно сохранились. Так что и в те далекие времена люди знали толк в борьбе с коррозией. Может быть, не все так безнадежно?
Виды коррозии металлов
Химическая коррозия
Химическая коррозия — это процесс разрушения металла, который связан с реакцией между металлом и коррозионной средой.
Химическая коррозия протекает без воздействия электрического тока, и в результате этой реакции металлы окисляются. Этот вид коррозии можно разделить на два подвида:
-
газовая коррозия — металл корродирует под воздействием различных газов при высоких температурах;
-
коррозия в жидкостях — неэлектролитах.
Их них более распространенной считают газовую коррозию. Она протекает во время прямого контакта твердого тела с активным газом воздуха. Чаще всего это кислород. В результате на поверхности тела образуется пленка продуктов химической реакции между веществом и газом. Дальше эта пленка мешает контакту корродирующего материала с газом. При высоких температурах газовая коррозия развивается интенсивно. Возникшая при этом пленка называется окалиной, которая со временем становится толще.
Важную роль в процессе коррозии играет состав газовой среды. Но для каждого металла он индивидуален и изменяется с переменой температур.
Электрохимическая коррозия
Электрохимическая коррозия — это разрушение металла, которое протекает при его взаимодействии с окружающей средой электролита.
Этот вид коррозии считают наиболее распространенным. Самым важным происхождением электрохимической коррозии является то, что металл неустойчив в окружающей среде с точки зрения термодинамики. Вот несколько ярких примеров этой реакции: ржавчина в трубопроводе, на обшивке днища морского судна и на различных металлоконструкциях в атмосфере.
В механизме электрохимической коррозии обычно выделяют два направления: гомогенное и гетерогенное. Разберем их подробнее в таблице ниже.
|
Гомогенный механизм электрохимической коррозии |
Гетерогенный механизм электрохимической коррозии |
|---|---|
|
Поверхность металла рассматривается как однородный слой. |
У твердых металлов поверхность неоднородна из-за структуры сплава, в котором атомы по-разному расположены в кристаллической решетке. |
|
Растворение металла происходит из-за термодинамической возможности для катодного или анодного процессов. |
Неоднородность можно наблюдать при наличии в сплаве каких-либо включений. |
|
Скорость, с которой протекает электрохимическая коррозия, зависит от времени протекания процесса. |
В электрохимической коррозии протекает одновременно два процесса на аноде и на катоде, которые зависят друг от друга. Растворение основного металла происходит только на анодах. Анодный процесс заключается в том, что ионы металла отрываются и переходят в раствор:
Fe → Fe2+ + 2e.
В результате происходит реакция окисления металла. В данном случае анод заряжается отрицательно.
При катодном процессе избыточные электроны переходят в молекулы или атомы электролита, которые, в свою очередь, восстанавливаются. На катоде идет реакция восстановления. Он носит заряд положительного электрода.
O2 + 2H2O + 4e → 4OH-
2H+ + 2e → H2
Торможение одного процесса приводит к торможению и другого процесса. Окисление металла может происходить только в анодном процессе.
Бесплатные занятия по английскому с носителем
Занимайтесь по 15 минут в день. Осваивайте английскую грамматику и лексику. Сделайте язык частью жизни.
Записаться на интенсив

Пример недопустимых гальванических пар:

Гальваническое действие может возникнуть, если строительную конструкцию из нержавеющей стали скреплять оцинкованными болтами. В этой нежелательной паре пострадает высоко анодный крепеж, поскольку его электроны будут перемещаться в направлении катодной нержавеющей стали. Поэтому, крепежные детали должны быть изготовлены из менее гальванически активного металла, чем материал металлоконструкции.

На скорость течения гальванокоррозии оказывает влияние площадь поверхности анода и катода. Если большой по размеру анод соединить с маленьким катодом, то анод будет ржаветь медленно, а если сделать наоборот, то быстро. Например, используйте болты из нержавеющей стали для крепления алюминия, но не наоборот.
Степень интенсивности протекания контактной коррозии зависит и от условий эксплуатации соединения. В обычных атмосферных условиях процесс будет протекать менее быстро и возрастает в агрессивной электропроводной среде, например, растворах кислот и щелочей. Присутствие в воде других веществ увеличивает проводимость электролита и скорость коррозии. Поэтому при проектировании конструкций важна оценка окружающей среды.
Условия
Коррозия – результат взаимодействия металла с веществами-окислителями, к которым относятся кислород, водород, кислоты, щёлочи. Основной характеристикой коррозии является окислительно-восстановительная реакция. Металл при коррозии окисляется, восстанавливая окислительный компонент среды.
Условиями для образования коррозии являются:
- наличие металла – простого или сложного вещества (сплава);
- наличие коррозионной среды – активных веществ, находящихся вокруг металла и воздействующих на его поверхность;
- продолжительный период времени.
Ржавчина – оксид или гидроксид железа (III) – образуется на железосодержащих изделиях и имеет рыжий цвет. Предметы из меди при коррозии приобретают зеленоватый оттенок. Это многослойная патина, верхний слой которой состоит из карбоната меди (II).
Коррозия классифицируется по нескольким признакам. Классификация приведена в таблице.
Признак
Вид
Описание
Захватывает всю металлическую поверхность
Охватывает часть поверхности
Глубоко поражает отдельные участки
Протекает под действием химических веществ в отсутствии электролитов. Может происходить на воздухе (газовая коррозия) и в водной среде (жидкостная коррозия). Под действием коррозионной среды металл окисляется, на поверхности образуются сульфидные, оксидные и другие плёнки, а коррозионные вещества восстанавливаются. Выделяют кислородную химическую коррозию и водородную деполяризацию
Протекает в присутствии электролита – проводящего ток вещества в растворах или в расплавах. Может происходить в грунте, море, атмосфере. Состоит из анодного и катодного процессов, взаимосвязанных между собой и протекающих одновременно. При анодном процессе металл окисляется, при катодном происходит восстановление окислителя, находящегося в растворе (расплаве)
Тип агрессивной среды
Происходит во влажной атмосфере
Протекает в отсутствии влаги
Происходит в кислых и щелочных почвах
Протекает в жидкой среде
Воздействие радиоактивных веществ
Соприкосновение двух металлов во влажной среде
Влияние живых организмов. Продукты жизнедеятельности бактерий окисляют и разрушают металл
Если в металле находятся примеси (соли, неметаллы, модификации углерода), то наблюдается ускоренная коррозия. Проверить это можно дома, опустив в соляной раствор (NaCl + H2O) металлическую деталь. Уже через сутки появится ржавчина.
Способы защиты от ржавления
Для борьбы с коварной ржавчиной применяются различные методы. Рассмотрим те из них, который являются наиболее эффективными.
Способ №1
Один из самых популярных методов – это электрохимическая защита чугуна, стали, титана, меди и других металлов. На чем же она основывается?
Чтобы обеспечить надежную защиту от ржавчины, необходимо еще перед началом эксплуатации металлических изделий обрабатывать их особым средствами, которые в своем составе содержат различные компоненты органического и неорганического происхождения. Данный метод позволяет предотвратить появление ржавчины на определенное время, однако позже придется обновлять покрытие.
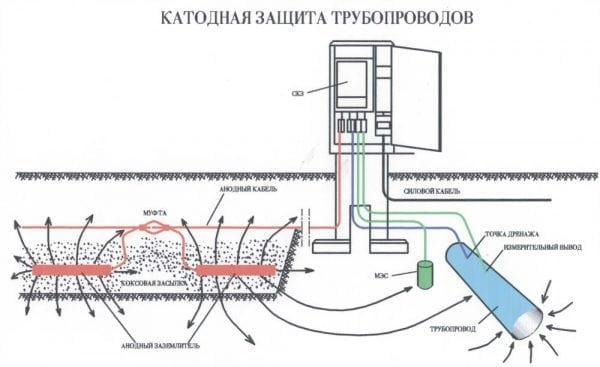
Электрозащита представляет собой процесс, при котором металлическая конструкция подключается к внешнему источнику постоянного электрического тока. В результате этого на ее поверхности формируется поляризация электродов катодного типа, и все анодные области начинают преобразовываться в катодные.
Катодная защита от коррозии необходима в тех ситуациях, когда у металла, подлежащего защите, не наблюдается предрасположенность к пассивации. К металлическому изделию подключается источник внешнего тока – специальная станция катодной защиты. Данный метод подходит для защиты газопроводов, а также трубопроводов водоснабжения и отопления. Однако есть у этого метода определенные недостатки в виде растрескивания и разрушения защитных покрытий – это происходит в случаях значительного смещения потенциала объекта в отрицательную сторону.
Способ №2
Электроискровая обработка металлов может осуществляться при помощи установок различных типов – бесконтактной, контактной, а также анодно-механической.
Способ №3
Для надежной защиты газопроводов и других трубопроводов от ржавчины часто применяется такой метод, как электродуговое напыление. Преимущества данного способа очевидны:

- значительная толщина защитного слоя;
- высокий уровень производительности и надежности;
- применение относительно недорогого оборудования;
- несложный технологический процесс;
- возможность применения автоматизированных линий;
- невысокие энергетические затраты.
Среди недостатков данного метода – невысокая эффективность при обработке конструкций в коррозийных средах, а также недостаточная прочность сцепления со стальной основой в некоторых случаях. В любых других ситуациях такая электрозащита очень эффективна.
Способ №4
Для защиты разнообразных металлических конструкций – газопроводов, мостовых сооружений, всевозможных трубопроводов – требуется эффективная антикоррозийная обработка.

Данная процедура осуществляется в несколько этапов:
- тщательное удаление жировых отложений и масел с применением эффективных растворителей;
- очистка обрабатываемой поверхности от солей, растворимых в воде, – выполняется при помощи профессиональных аппаратов высокого давления;
- удаление имеющихся конструкционных погрешностей, выравнивание кромок – это необходимо для предотвращения сколов наносимого лакокрасочного покрытия;
- тщательная очистка поверхности при помощи пескоструйного аппарата – это делается не только для удаления ржавчины, но и для придания нужной степени шероховатости;
- нанесение противокоррозийного материала и дополнительного защитного слоя.
Правильная предварительная обработка газопроводов и всевозможных металлоконструкций обеспечит им надежную защиту от электрохимической коррозии в процессе эксплуатации.
Источник
Какие механизмы отвечают за протекание электрохимической коррозии
Такое повреждение металла проводится двумя механизмами – гомогенным и гетерогенным. Рассмотрим каждый из них подробно.
- Гомогенный. Первоначально затрагивается поверхностный слой металлического изделия. Постепенно металл начинает растворяться под действием актов – катодного или анодного. На протяжении определенного времени происходит миграция катода и анода. Со временем процесс ускоряется. Особенность гомогенного механизма в том, что затрагивает как твердые, так и жидкие металлы. Меняется только скорость течения.
- Гетерогенный. У большинства твердых металлов не наблюдается гомогенной поверхности. Это связано с тем, что в самом материале состав кристаллической решетки может отличаться. Также как и в описанном выше случае, формируется анодный и катодный процессы, металл начинает постепенно разрушаться.
У такого вида процесса есть несколько особенностей.
В первую очередь – четкое деление на катодный и анодный процесс. Один из основных факторов, влияющих на их скорость протекания относительно друг друга – это время.
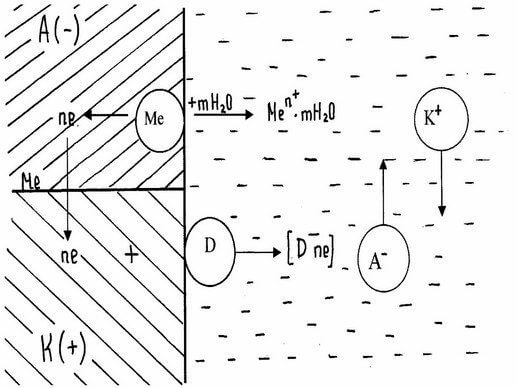
Схема электрохимической коррозии
В зависимости от типа металла, коррозия может быть локализована на отдельных участках. Также наблюдается растворение поверхностного слоя на анодах, что позволяет поражению затронуть обширные площади.
Здесь появляется еще одна особенность протекания процесса – формирование гальванических элементов. Это происходит из-за специфики структуры поверхности, на которой присутствуют микроэлектроды.
Методы защиты металлов от коррозии
Для защиты металлов от коррозии применяются различные методы: легирование металлов, обработка коррозионной среды, электрохимическая защита, нанесение металлических и неметаллических покрытий.
Легирование металлов позволяет получать коррозионностойкие сплавы, превосходящие по стойкости основной металл. Примерами могут служить сплавы меди (латунь и бронза), ее легирование алюминием для повышения коррозионной стойкости в атмосферных условиях; легирование стали хромом и никелем с целью создания хромоникелевых сплавов.
Обработку коррозионной среды выполняют с целью уменьшения ее агрессивного воздействия на металл. Однако такая обработка целесообразна при небольших объемах электролитов. Обработка среды заключается во введении в среду ингибиторов коррозии или в уменьшении содержания деполяризатора в электролитах.
Ингибиторы коррозии, введенные в коррозионную среду в малых количествах, полностью предотвращают коррозию металлов или значительно снижают ее скорость. В зависимости от характера среды ингибиторы выступают как замедлители кислотной или щелочной коррозии, коррозии в нейтральных растворах, в неводных средах. В основном, ингибиторы являются органическими соединениями.
Электрохимическая защита подразделяется на катодную и анодную защиту. Катодная защита подразделяется на защиту внешним током и протекторную защиту.
Механизм защиты внешним током (рис. 1) сводится к тому, что за счет внешней катодной поляризации защищаемому металлу навязывают потенциал, при котором его коррозия замедляется. Суть этого способа заключается в том, что защищаемую конструкцию подсоединяют к отрицательному полюсу внешнего источника постоянного тока, а к положительному полюсу подсоединяют электрод, которым может являться металлолом, а именно отрезок стальной трубы, рельсы и т. п. (рис. 1).
Протекторная защита (рис. 2) состоит в том, что к защищаемой конструкции подсоединяют металл или сплав, электродный потенциал которого более электроотрицателен, чем потенциал металла защищаемой конструкции. В качестве протекторов обычно используют цинк или сплавы цинка с алюминием. Иногда применяют сплавы на основе магния. Протекторы применяют для защиты металлических конструкций от коррозии в морской воде, других нейтральных коррозионных средах, а также в почве.
Рис. 1. Схема катодной защиты внешним током: 1 – источник постоянного тока; 2 – соединительный провод; 3 – пункт дренажа; 4 – защищаемая труба; 5 – изолирующее покрытие; 6 – анодное заземление; 7 – соединительный провод
Рис. 2. Схема протекторной защиты: 1 – подземная стальная конструкция; 2 – протектор–магниевый сплав; 3 – заполнитель; 4 – электрический контакт; 5 – контрольно-измерительный вывод; 6 – закороченные клеммы; Iп.з – сила тока протекторной защиты
Защита металлическими и неметаллическими покрытиями. Для защиты металлов от коррозии используют различные виды покрытий: металлические, лакокрасочные и полимерные покрытия и покрытия, образованные в результате химической или электрохимической обработки поверхности металла. Роль любого покрытия сводится в основном к изоляции металла от внешней среды.
Выбор типа покрытия зависит от условий, в которых следует использовать металл. Для защиты изделий, не подвергающихся механическим воздействиям и применяющимся в сухих жилых помещениях, обычно бывает достаточно однослойного лакокрасочного покрытия или соответствующей химической обработки поверхности металла: оксидирования или фосфатирования. Для защиты металлических конструкций (железнодорожные мосты, подъемные краны и т. п.), а также железнодорожных вагонов, наружных деталей автомобилей, велосипедов и др., подвергающихся воздействию влажной атмосферы, применяют сложные по составу и способу нанесения лакокрасочные покрытия.
Металлическое защитное покрытие
Наиболее интересной и перспективной является электрохимическая защита от коррозии другим видом металла. По характеру защитного воздействия металлизированные покрытия подразделяют на анодные и катодные. Остановимся на этом моменте более подробно.
Анодным называется покрытие, образованное более активным (менее благородным) металлом, чем тот, что защищают. То есть осуществляется защита элементом, который стоит в ряду напряжений до основного материала (например, покрытие железа цинком или кадмием). При местных разрушениях защитного слоя корродировать будет менее благородный металл-покрытие. В зоне царапин и трещин образовывается локальный гальванический элемент, катодом в котором является ограждаемый металл, а анодом – покрытие, которое окисляется. Целостность такой защитной пленки значения не имеет. Однако чем она толще, тем медленнее будет развиваться электрохимическая коррозия, дольше будет длиться полезный эффект.
Катодным называется покрытие металлом с большим потенциалом, который в ряду напряжений стоит после защищаемого материала (например, напыление низколегированных сталей медью, оловом, никелем, серебром). Покрытие должно быть сплошным, так как при его повреждении образовываются локальные гальванические элементы, в которых основной металл будет анодом, а защитный слой – катодом.

Коррозия металлов и способы защиты от нее
Коррозией металла называют процесс его самопроизвольного разрушения в результате контакта с окружающей средой.
Коррозия бывает химическая и электрохимическая.
Химическая коррозия — вид коррозии, при котором металл разрушается из-за его взаимодействия с газами или жидкостями, не проводящими электрический ток. Так, например, к химической коррозии относится образование окалины при взаимодействии железа с кислородом при высоких температурах, а также разрушение металлического оборудования под действием нефтяных фракций, содержащих сернистые соединения.
Электрохимической коррозией называют разрушение металла в растворе электролита вследствие возникновения в данной системе электрических токов. Электрические токи, способствующие коррозии, возникают в тех случаях, когда в растворе электролита изделие из металла контактирует с другим менее активным металлом. Также такие токи могут появляться из-за химической неоднородности металлического материала, из которого выполнено изделие.
Так, например, из-за электрохимической коррозии страдают подводные части судов, паровые котлы, трубопроводы, металлические конструкции в почве и т.д.
Способы защиты металлов от коррозии
1) Контроль условий, в которых эксплуатируется металлическое оборудование. Например, хранение и использование изделий из стали на открытом воздухе нежелательно и этого, по возможности, следует избегать. Эксплуатация металлического оборудования в помещениях с низкой влажностью существенно продлит его срок службы.
2) Создание защитных покрытий, изолирующих металлоконструкцию от контакта с окружающей средой. Среди таких покрытий различают:
— неметаллические покрытия — всевозможные краски, лаки, эмали, а также пленки из таких полимеров, как полиэтилен, поливинилхлорид и т.д.;
— химические покрытия (оксидные, нитридные, фосфатные и т.д.) (Такие покрытия получают специальной химической обработкой поверхности металла.);
— металлические покрытия.
Металлические покрытия получают нанесением на защищаемую металлическую конструкцию тонкого слоя другого металла (чаще всего с помощью процесса электролиза).
При этом, если в качестве покрытия используется менее активный металл, то такое покрытие будет защищать металлоконструкцию только при условии его целостности. В случае, если целостность такого покрытия будет нарушена, защищаемый металл будет ускоренно корродировать.
Также широко используется покрытие металлоконструкций более активным металлом. Например, распространено использование так называемого оцинкованного железа. Такое покрытие защищает металлические объекты даже при нарушении его целостности, поскольку пока практически полностью не исчезнет слой покрытия из более активного металла, коррозия металла, из которого сделан защищаемый объект, не начнется.
3) Электрохимические методы защиты:
— катодная защита — вид защиты, при котором металлический объект подключается с помощью проводников к катоду внешнего источника тока либо же приводится в контакт с более активным металлом.
Частный случай катодной защиты, при котором металлическая конструкция приводится в контакт с более активным металлом, называют протекторной защитой.
4) Изменение химических свойств среды, в которой эксплуатируется металлическое изделие, в частности:
— добавление в среду веществ, замедляющих коррозию (ингибиторов коррозии).
— дегазация среды (удаление растворенных в ней газов, в частности, кислорода). Например, такой метод работает для защиты от ржавления железа, поскольку в процессе ржавления железа активное участие принимает не только вода, но и кислород:
4Fe + 6H2O + 3O2 = 4Fe(OH)3
Главные внутренние факторы протекания электрохимической коррозии
На интенсивность распространения коррозийного поражения влияют две группы факторов – внешние и внутренние.
Текущее состояние поверхности металла
Когда поверхность металла неровная, коррозийный процесс протекает намного интенсивнее. Если на поверхности присутствуют небольшие выступы, они начинают накапливать воду.
Это может негативно повлиять на интенсивность распространения.
Чтобы не допустить такого фактора, важно использовать отшлифованный или отполированный металл. Когда сталь гладкая, вода не так сильно повреждает ее, потому что постепенно происходит формирование равномерной пленки по всей поверхности
Когда сталь гладкая, вода не так сильно повреждает ее, потому что постепенно происходит формирование равномерной пленки по всей поверхности.
Также хорошим средством для уменьшения поражения становится применение пассивирования, а также ряд других способов.
Степень термодинамической стойкости металла
Разные виды материалов отличаются разными показателями термодинамической устойчивости.
Наиболее стойкие разновидности материала не разрушаются при помещении в агрессивную среду.
Именно такой фактор оказывает большое влияние на потенциальное воздействие среды на постепенное развитие коррозии.
К сожалению, у большинства представленных в продаже марок металлов стойкость невысокая. Есть и неустойчивые разновидности, у которых этот риск нивелируется благодаря склонности к образованию пассивных пленок на поверхности.
Кристаллографическая структура
Оказывает прямое воздействие на металл.
Как известно, атомы в кристаллической решетке располагаются по-разному. Лучше защищены те разновидности, у которых атомы упакованы неплотно.
Особенности решетки также учитывают при планировании защиты материала методом создания на нем специальных пленок. И пленка и сам основной материал должны четко соответствовать по составу друг другу или быть максимально приближенными.
В этом случае исключается появление напряжения, которое негативно отражается на текущем состоянии заготовки. Если контакт с агрессивной средой все-таки происходит, материал начинает разрушаться слой за слоем.
Гетерогенность
Этот фактор рассматривается в непосредственной связи с величиной зерна металла.
Если в сплаве есть выраженные анодные включения, они сильно влияют на ускорение протекания коррозии.
Катодные включения не столь опасны, потому что на интенсивности процесса не отражаются. Величина зерна как фактор риска рассматривается не так часто и этим показателем можно пренебречь.





























