Краска для защиты металла: особенности и этапы нанесения
Химтраст производит краски, которые обеспечивают надежную защиту поверхности металла от коррозии.
«Эмаль ПФ-115» и «Грунт ГФ-021» рекомендуем использовать в комплексе для эффективного антикоррозионного действия, снижения расхода, прочного покрытия. Рассмотрим пошагово технологию нанесения.
Поверхность тщательно очищаем от загрязнений, обезжириваем при необходимости.
«Грунт ГФ-021» перемешиваем в течение 5 минут на скорости 300–450 об/мин миксером со спиралевидной насадкой, уделяем внимание области на дне, у стенок тары. Для обеспечения рабочей вязкости разбавляем состав уайт-спиритом, сольвентом или их смесью в пропорции 1:1.
Наносим «Грунт ГФ-021» в два мокрых слоя по 25–35 мкм кистью, валиком, шпателем, аппаратом безвоздушного распыления
Время межслойной сушки — 2 часа при температуре 25 °С.
Чтобы «Эмаль ПФ-115» выполнила функцию защиты металла от коррозии, обеспечиваем материалу рабочую температуру — 15–25 °С. Перемешиваем состав миксером со спиралевидной насадкой на скорости 300–450 об/мин. Разбавляем при необходимости до обеспечения рабочей вязкости уайт-спиритом, сольвентом или их смесью в соотношении 1:1 по массе.
Наносим «Эмаль ПФ-115» в два мокрых слоя по 25–35 мкм кистью, валиком, шпателем, аппаратом безвоздушного распыления. Время межслойной сушки — 2 часа при температуре 25 °С.
Важно! Не используйте материал, если обнаружили, что упаковка негерметична, повреждена или истек срок годности состава.
 |
 |
Грунт-эмаль «Химтраст Антикор 3 в 1» — модифицированный состав, который не требует нанесения дополнительного грунтовочного слоя. Состав колеруется по стандартному каталогу RAL.
«Антикор 3 в 1» наносить можно безвоздушным и пневматическим распылением, кистью или валиком на заранее очищенную, обезжиренную поверхность металла в 2–3 слоя. Допустимо нанесение грунт-эмали на плотно сцепленные остатки ржавчины — до 70 мкм, остатки старого покрытия, плотно сцепленные с металлом.
Интервал межслойной выдержки — 1,5 часа при температуре (20±2) °С. Толщина готового покрытия после нанесения не должна превышать 120 мкм. При необходимости состав можно разбавить ксилолом или толуолом, но не более 10 % от массы грунт-эмали. Финишное покрытие после полимеризации — однородное полуглянцевое. Допустимый температурный диапазон эксплуатации от −40 °С до +140 °С.
Мы провели испытания методом А по ГОСТ 9.403–80 «Методы испытаний на стойкость к статическому воздействию жидкостей» для состава «Антикор 3 в 1», чтобы оценить стойкость к воздействию воды, раствора соли, масел. Время, в течение которого образцы подвергались испытаниям: 24 часа. Для погружения образцов подготовили 4 вида растворов:
- вода дистиллированная по ГОСТ 6709–72;
- натрий хлористый по ГОСТ 4233–77, 3%-й раствор;
- минеральное масло по ГОСТ 20799–88;
- трансформаторное масло.
Смотрите на видео результаты испытания и правильную технологию нанесения «Антикор 3 в 1».
|
При выборе материалов для защиты поверхности металла от коррозии ориентируйтесь на качественные характеристики состава:
|
|---|
Современные лакокрасочные материалы — превентивная мера по защите металлов и сплавов от коррозии. Эффективность окрашивания зависит от качества материалов и подготовки поверхности — на субстрате металла должны отсутствовать дефекты, загрязнения в области сварочных швов, завернувшиеся корки, окалина.
Материалы поставляем в металлических ведрах 20 кг. Продукция всегда в наличии к заказу. Доставляем материалы во все регионы России и СНГ. Действует скидочная программа.
Коррозия железа и меди
Коррозия железа
Давно выявлено, что зачастую коррозия (ржавчина) на железных элементах возникает вследствие протекания реакций окисления воздухом или кислотами – окислительно-восстановительные реакции. Как и в любом металле, ржавчина захватывает верхние слои железного изделия и возникает химическая коррозия, электрохимическая или электрическая.
Если рассмотреть каждый этот процесс в отдельности то получится, что при химическом возникновении ржавчины происходит переход электронов на окислитель, в результате образовывается оксидная пленка, а реакция выглядит так:
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3)
Образовавшаяся пленка не защищает материал от дальнейшего возникновения окислительно-восстановительных реакций, она свободно пропускает воздух, что способствует образованию новой ржавчины.
При электрохимической коррозии, которая чаще всего возникает с железом в грунте, протекает реакция с образованием свободного кислорода и воды, если они остаются на железном элементе, то это вызывает новые продукты коррозии.
Fe + O2 + H2O → Fe2O3 · xH2O
Электрическая коррозия железа является самой непредсказуемой, так как возникает из-за блуждающих токов, которые могут попадать к железному элементу от линий электропередач, трамвайных путей, крупногабаритного электрооборудования и другое. Блуждающий ток запускает процесс электролиза металла, а он способствует образованию ржавых пятен.
Коррозия меди
При эксплуатации медных элементов необходимо учитывать причины коррозии, зачастую они обусловлены средой, где находится элемент. Например, в таких средах как: атмосферная, морская вода, при контакте с галогеновыми веществами и в слабых растворах солей медь коррозирует стабильно медленно.
Также медь подвергается коррозии в обычных атмосферных условиях:
2Cu+H2O+CO2+O2→ CuCO3*Cu(OH)2

Методы защиты металлов от коррозии
Для защиты металлов от коррозии применяются различные методы: легирование металлов, обработка коррозионной среды, электрохимическая защита, нанесение металлических и неметаллических покрытий.
Легирование металлов позволяет получать коррозионностойкие сплавы, превосходящие по стойкости основной металл. Примерами могут служить сплавы меди (латунь и бронза), ее легирование алюминием для повышения коррозионной стойкости в атмосферных условиях; легирование стали хромом и никелем с целью создания хромоникелевых сплавов.
Обработку коррозионной среды выполняют с целью уменьшения ее агрессивного воздействия на металл. Однако такая обработка целесообразна при небольших объемах электролитов. Обработка среды заключается во введении в среду ингибиторов коррозии или в уменьшении содержания деполяризатора в электролитах.
Ингибиторы коррозии, введенные в коррозионную среду в малых количествах, полностью предотвращают коррозию металлов или значительно снижают ее скорость. В зависимости от характера среды ингибиторы выступают как замедлители кислотной или щелочной коррозии, коррозии в нейтральных растворах, в неводных средах. В основном, ингибиторы являются органическими соединениями.
Электрохимическая защита подразделяется на катодную и анодную защиту. Катодная защита подразделяется на защиту внешним током и протекторную защиту.
Механизм защиты внешним током (рис. 1) сводится к тому, что за счет внешней катодной поляризации защищаемому металлу навязывают потенциал, при котором его коррозия замедляется. Суть этого способа заключается в том, что защищаемую конструкцию подсоединяют к отрицательному полюсу внешнего источника постоянного тока, а к положительному полюсу подсоединяют электрод, которым может являться металлолом, а именно отрезок стальной трубы, рельсы и т. п. (рис. 1).
Протекторная защита (рис. 2) состоит в том, что к защищаемой конструкции подсоединяют металл или сплав, электродный потенциал которого более электроотрицателен, чем потенциал металла защищаемой конструкции. В качестве протекторов обычно используют цинк или сплавы цинка с алюминием. Иногда применяют сплавы на основе магния. Протекторы применяют для защиты металлических конструкций от коррозии в морской воде, других нейтральных коррозионных средах, а также в почве.
Рис. 1. Схема катодной защиты внешним током: 1 – источник постоянного тока; 2 – соединительный провод; 3 – пункт дренажа; 4 – защищаемая труба; 5 – изолирующее покрытие; 6 – анодное заземление; 7 – соединительный провод
Рис. 2. Схема протекторной защиты: 1 – подземная стальная конструкция; 2 – протектор–магниевый сплав; 3 – заполнитель; 4 – электрический контакт; 5 – контрольно-измерительный вывод; 6 – закороченные клеммы; Iп.з – сила тока протекторной защиты
Защита металлическими и неметаллическими покрытиями. Для защиты металлов от коррозии используют различные виды покрытий: металлические, лакокрасочные и полимерные покрытия и покрытия, образованные в результате химической или электрохимической обработки поверхности металла. Роль любого покрытия сводится в основном к изоляции металла от внешней среды.
Выбор типа покрытия зависит от условий, в которых следует использовать металл. Для защиты изделий, не подвергающихся механическим воздействиям и применяющимся в сухих жилых помещениях, обычно бывает достаточно однослойного лакокрасочного покрытия или соответствующей химической обработки поверхности металла: оксидирования или фосфатирования. Для защиты металлических конструкций (железнодорожные мосты, подъемные краны и т. п.), а также железнодорожных вагонов, наружных деталей автомобилей, велосипедов и др., подвергающихся воздействию влажной атмосферы, применяют сложные по составу и способу нанесения лакокрасочные покрытия.
Основные способы защиты
Для борьбы с электрохимической коррозией, обусловленной образованием гальванической пары, применяются следующие основные меры:
- Использование металлов и сплавов, устойчивых к коррозии. Например, меди или алюминия, у которых на поверхности образуется тонкая оксидная пленка, защищающая от коррозии предметы, изготовленные из данных металлов. Или нержавеющей стали, в которую добавлены присадки, изменяющие внутреннюю структуру материала таким образом, чтобы в нем не было неоднородностей с разными электрохимическими потенциалами.
- Гальваническое покрытие. Например, на обычную сталь наносят слой меди. Именно такая защита применяется в готовых наборах заземлителей ZANDZ
- Покрытие из диэлектрического материала, устойчивое к влаге, например, краска или лак.
- Применение во влажных условиях, по возможности, однородных материалов.
- Катодная защита, суть которой заключается в приложении к защищаемому элементу отрицательного потенциала.
- Соединение оцинкованных заземлителей с арматурой в бетоне лишь через искровые разрядники, способные проводить частичные разряды молнии. Разница потенциалов между стальными и цинковыми элементами много меньше напряжения пробоя разрядника, поэтому в обычных условиях электрохимическая коррозия протекать не будет.
Оксидирование алюминия
Оксидирование алюминия протекает при постоянном токе под напряжением 250 В. Наращивание защитной пленки происходит при комнатной температуре с водяным охлаждением. Не требуется импульсного источника. Пленки получаются плотными и прочными в течение 45-60 минут.
На плотность и цвет оксидного покрытия влияет температура электролита:
- пониженная температура образует плотную пленку яркого цвета;
- повышенная – формирует рыхлую пленку, требующую дальнейшей окраски.
Образовать защиту алюминия от коррозии можно электрохимической реакцией. Процесс разделен на несколько этапов:
1. На стадии подготовки алюминиевое изделие обезжиривают, погружая его в раствор щавелевой кислоты.
2. После промывания водой опускают в щелочной раствор, чтобы удалить неравномерно образовавшийся оксидный слой.
3. Для дополнительной окраски алюминиевые изделия погружают в соответствующие растворы солей. Чтобы заполнить образовавшиеся поры, металлический материал обрабатывают паром.

4. Затем изделие подвергают сушке. Анодное оксидирование может проводиться с применением переменного тока.
Для защиты от коррозии применяют химическое оксидирование – менее затратное, не требующее специального электрического оборудования и квалификации исполнителей. Используется несложный химический состав.
Статья по теме: Подробное руководство по видам коррозии
В процессе алюминирования полученная оксидная пленка толщиной в 3 мкм имеет салатный цвет, обладает высокими электроизоляционными свойствами, не пориста, не окрашивается.
Коррозия алюминия возникает вследствие находящихся рядом металлов, которые окислились. Предотвращению этот процесса способствует изоляция. Это могут быть прокладки из резины, битума, паронита. При покрытии ржавчиной применяются лак и другие изолирующие материалы. Других способов избавиться от этой проблемы пока нет.
Виды коррозии
Как уже говорилось, критериев классификация коррозионных процессов существует множество. Так, различают коррозию по виду распространения (сплошная, местная), по типу коррозионной среды (газовая, атмосферная, жидкостная, почвенная), по характеру механических воздействий (коррозионное растрескивание, явление Фреттинга, кавитационная коррозия) и так далее.
Но основным способом классификации коррозии, позволяющим наиболее полно объяснить все тонкости этого процесса, является классификация по механизму протекания.
По этому критерию различают два вида коррозии:
- химическую
- электрохимическую
Химическая коррозия
Химическая коррозия отличается от электрохимической тем, что протекает в средах, не проводящих электрический ток. Поэтому при такой коррозии разрушение металла не сопровождается возникновением электрического тока в системе. Это обычное окислительно-восстановительное взаимодействие металла с окружающей средой.
Наиболее типичным примером химической коррозии является газовая коррозия. Газовую коррозию еще называют высокотемпературной, поскольку обычно она протекает при повышенных температурах, когда возможность конденсации влаги на поверхности металла полностью исключена. К такому виду коррозии можно отнести, например, коррозию элементов электронагревателей или сопел ракетных двигателей.

Скорость химической коррозии зависит от температуры — при ее повышении коррозия ускоряется. Из-за этого, например, в процессе производства металлического проката, во все стороны от раскаленной массы разлетаются огненные брызги. Это с поверхности металла скалываются частички окалины.
Окалина — типичный продукт химической коррозии, — оксид, возникающий в результате взаимодействия раскаленного металла с кислородом воздуха.

Помимо кислорода и другие газы могут обладать сильными агрессивными свойствами по отношению к металлам. К таким газам относятся диоксид серы, фтор, хлор, сероводород. Так, например, алюминий и его сплавы, а также стали с высоким содержанием хрома (нержавеющие стали) устойчивы в атмосфере, которая содержит в качестве основного агрессивного агента кислород. Но картина кардинально меняется, если в атмосфере присутствует хлор.
В документации к некоторым антикоррозионным препаратам химическую коррозию иногда называют «сухой», а электрохимическую — «мокрой». Однако химическая коррозия может протекать и в жидкостях. Только в отличие от электрохимической коррозии эти жидкости — неэлектролиты (т.е. не проводящие электрический ток, например спирт, бензол, бензин, керосин).
Примером такой коррозии является коррозия железных деталей двигателя автомобиля. Присутствующая в бензине в качестве примесей сера взаимодействует с поверхностью детали, образуя сульфид железа. Сульфид железа очень хрупок и легко отслаивается, освобождая свежую поверхность для дальнейшего взаимодействия с серой. И так, слой за слоем, деталь постепенно разрушается.
Электрохимическая коррозия
Если химическая коррозия представляет собой не что иное, как простое окисление металла, то электрохимическая — это разрушение за счет гальванических процессов.
В отличие от химической, электрохимическая коррозия протекает в средах с хорошей электропроводностью и сопровождается возникновением тока. Для «запуска» электрохимической коррозии необходимы два условия: гальваническая пара и электролит.
В роли электролита выступает влага на поверхности металла (конденсат, дождевая вода и т.д.). Что такое гальваническая пара? Чтобы понять это, вернемся к ряду активности металлов.

Смотрим. Cлева расположены более активные металлы, справа — менее активные.
Если в контакт вступают два металла с различной активностью, они образуют гальваническую пару, и в присутствии электролита между ними возникает поток электронов, перетекающих от анодных участков к катодным. При этом более активный металл, являющийся анодом гальванопары, начинает корродировать, в то время как менее активный коррозии не подвергается.
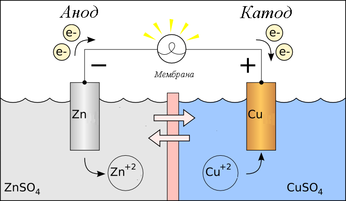 Схема гальванического элемента
Схема гальванического элемента
Для наглядности рассмотрим несколько простых примеров.
Допустим, стальной болт закреплен медной гайкой. Что будет корродировать, железо или медь? Смотрим в ряд активности. Железо более активно (стоит левее), а значит именно оно будет разрушаться в месте соединения.
 Стальной болт — медная гайка (корродирует сталь)
Стальной болт — медная гайка (корродирует сталь)
А если гайка алюминиевая? Снова смотрим в ряд активности. Здесь картина меняется: уже алюминий (Al), как более активный металл, будет терять электроны и разрушаться.
Таким образом, контакт более активного «левого» металла с менее активным «правым» усиливает коррозию первого.
Виды коррозии металлов
Химическая коррозия
Химическая коррозия — это процесс разрушения металла, который связан с реакцией между металлом и коррозионной средой.
Химическая коррозия протекает без воздействия электрического тока, и в результате этой реакции металлы окисляются. Этот вид коррозии можно разделить на два подвида:
-
газовая коррозия — металл корродирует под воздействием различных газов при высоких температурах;
-
коррозия в жидкостях — неэлектролитах.
Их них более распространенной считают газовую коррозию. Она протекает во время прямого контакта твердого тела с активным газом воздуха. Чаще всего это кислород. В результате на поверхности тела образуется пленка продуктов химической реакции между веществом и газом. Дальше эта пленка мешает контакту корродирующего материала с газом. При высоких температурах газовая коррозия развивается интенсивно. Возникшая при этом пленка называется окалиной, которая со временем становится толще.
Важную роль в процессе коррозии играет состав газовой среды. Но для каждого металла он индивидуален и изменяется с переменой температур.
Электрохимическая коррозия
Электрохимическая коррозия — это разрушение металла, которое протекает при его взаимодействии с окружающей средой электролита.
Этот вид коррозии считают наиболее распространенным. Самым важным происхождением электрохимической коррозии является то, что металл неустойчив в окружающей среде с точки зрения термодинамики. Вот несколько ярких примеров этой реакции: ржавчина в трубопроводе, на обшивке днища морского судна и на различных металлоконструкциях в атмосфере.
В механизме электрохимической коррозии обычно выделяют два направления: гомогенное и гетерогенное. Разберем их подробнее в таблице ниже.
|
Гомогенный механизм электрохимической коррозии |
Гетерогенный механизм электрохимической коррозии |
|---|---|
|
Поверхность металла рассматривается как однородный слой. |
У твердых металлов поверхность неоднородна из-за структуры сплава, в котором атомы по-разному расположены в кристаллической решетке. |
|
Растворение металла происходит из-за термодинамической возможности для катодного или анодного процессов. |
Неоднородность можно наблюдать при наличии в сплаве каких-либо включений. |
|
Скорость, с которой протекает электрохимическая коррозия, зависит от времени протекания процесса. |
В электрохимической коррозии протекает одновременно два процесса на аноде и на катоде, которые зависят друг от друга. Растворение основного металла происходит только на анодах. Анодный процесс заключается в том, что ионы металла отрываются и переходят в раствор:
Fe → Fe2+ + 2e.
В результате происходит реакция окисления металла. В данном случае анод заряжается отрицательно.
При катодном процессе избыточные электроны переходят в молекулы или атомы электролита, которые, в свою очередь, восстанавливаются. На катоде идет реакция восстановления. Он носит заряд положительного электрода.
O2 + 2H2O + 4e → 4OH-
2H+ + 2e → H2
Торможение одного процесса приводит к торможению и другого процесса. Окисление металла может происходить только в анодном процессе.
Бесплатные занятия по английскому с носителем
Занимайтесь по 15 минут в день. Осваивайте английскую грамматику и лексику. Сделайте язык частью жизни.
Записаться на интенсив
Технический прогресс в развитии методов борьбы с коррозией
Так как коррозионные потери металла составляют астрономическую сумму, технический прогресс продолжает предлагать новые методы борьбы с ней, по мере развития научных исследований и совершенствования аппаратного обеспечения. К ним относятся:
- газотермическое напыление, образующее сверхтонкие защитные покрытия;
- термодиффузионные покрытия, создающие прочную поверхностную защиту;
- кадмирование, обеспечивающее защиту стали в морской воде.
Рост промышленного производства происходит с постоянным увеличением выпуска металлических изделий. Электрохимическая коррозия, вне зависимости от исторической эпохи, представляет постоянную угрозу огромному объему конструкций и ответственных сооружений. Поэтому создание новых методов и средств борьбы — одна из задач исследований технического прогресса.
Современные методы борьбы
Многочисленные исследования и развитие технического прогресса привели к созданию целой системы методов и средств в борьбе с коррозией. Можно отметить три основных направления в защите от коррозии:
- Конструктивные решения.
- Активные методы.
- Пассивные методы.
Конструктивные решения состоят в выборе материалов, которые минимально поддаются коррозии по своим физическим свойствам:
- нержавеющие стали;
- легированные стали;
- цветные металлы.
 Активные методы борьбы подсказала сама электрохимическая коррозия. Постоянное напряжение прикладывают к защищаемой металлической конструкции так, чтобы повысить его электродный потенциал и замедлить процесс электрохимического растворения. Второй вариант активной защиты — жертвенный анод, который имеет низкий электродный потенциал, вследствие чего разрушается вместо защищаемого объекта.
Активные методы борьбы подсказала сама электрохимическая коррозия. Постоянное напряжение прикладывают к защищаемой металлической конструкции так, чтобы повысить его электродный потенциал и замедлить процесс электрохимического растворения. Второй вариант активной защиты — жертвенный анод, который имеет низкий электродный потенциал, вследствие чего разрушается вместо защищаемого объекта.
Пассивные методы состоят в нанесении защитных покрытий. Технический прогресс в этой области начал развиваться с нанесения простейших лакокрасочных покрытий, предотвращающих попадания кислорода, влаги и конденсата на поверхность металлов. Затем появились гальванические покрытия на основе:
- цинка — цинкование;
- хрома — хромирование;
- никеля — никелирование.
Оцинкованное железо, никелированные и хромированные столовые приборы, консервные банки с продуктами служат многие годы, не поддаваясь электрохимической коррозии, сохраняя красивый внешний вид, предохраняя порчу продуктов.
О видах коррозии
Всего существует несколько разновидностей коррозии металлических труб:
- поверхностная, распространяющаяся по всей площади трубы;
- местная, расположенная на отдельных участках;
- щелевая, образовавшаяся в небольшой трещине.
Наиболее настораживает местная коррозия, так как основная масса повреждений происходит в результате ее появления. Развитие щелевой тоже распространено, но к существенным повреждениям материала она не приводит.

Процент вероятности возникновения коррозии в большую сторону отдается участкам труб, продолженных под железнодорожными переездами или под опорами линий воздушных электропередач. Скорость развития процесса коррозии колеблется от 3 до 30 мм в год.
Что такое химическая коррозия
Этот процесс возникает в неэлектропроводных средах. Ими могут оказаться газы, нефтепродукты и спиртовые соединения. При повышении температурных показателей скорость развития коррозии возрастает. Ржавчина может образовываться на цветных или черных металлах. Алюминиевые изделия под влиянием коррозионных факторов покрываются тонкой пленкой, которая после обеспечивает систему защиты и создает препятствие развитию окислительного процесса.


Сплавы могут быть восприимчивы к иному виду ржавчины, то есть присутствуют элементы, не подверженные окислению, а напротив, они восстановленные. К примеру, при повышенных температурных характеристиках и повышенном давлении восстанавливаются карбиды, но, опять же, утрачиваются нужные качества.
Об электрохимической коррозии
Утверждение о том, что электрохимическая коррозия достигается только при контактировании металлической поверхности с электролитом, ошибочно. Хватает тонкой пленки на основании материала, чтобы образовалась коррозия. Причиной этого вида ржавчины является использование поваренной или технической солей. К, примеру, если производится посыпка снега на дорогах, то страдают машины и проложенные под землей трубопроводы.

Процесс этого происхождения заключается в следующем:
- В соединениях металлических конструкций теряются отчасти атомы, осуществляется их переход в электролитический раствор, то есть происходит образование ионов. Замещают электроны атомы, они заряжают материал отрицательными зарядами, при этом накапливаются положительные заряды в электролите.
- Электрохимическую коррозию также вызывают блуждающие токи, которые при утечке из электроцепи уходят в растворы воды или в грунт, а после в саму структуру металла. Конкретными местами проявления ржавчины являются те участки, откуда в воду попадают блуждающие токи.
Статья по теме: Как предотвратить коррозию бетона и защитить материал от разрушения?
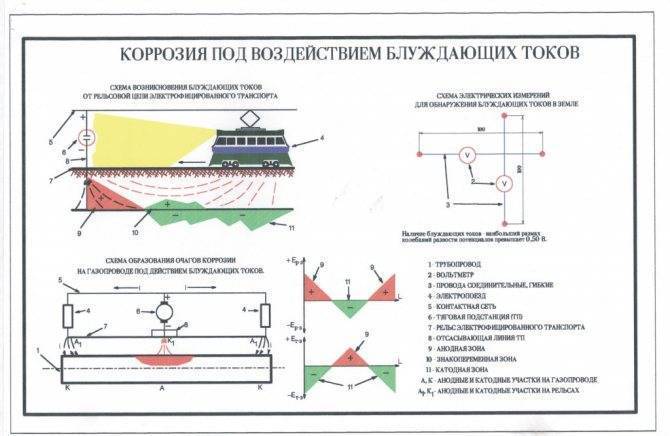
На видео: электрохимическая коррозия металлов и способы защиты.
Способы защиты от ржавления
Для борьбы с коварной ржавчиной применяются различные методы. Рассмотрим те из них, который являются наиболее эффективными.
Способ №1
Один из самых популярных методов – это электрохимическая защита чугуна, стали, титана, меди и других металлов. На чем же она основывается?
Чтобы обеспечить надежную защиту от ржавчины, необходимо еще перед началом эксплуатации металлических изделий обрабатывать их особым средствами, которые в своем составе содержат различные компоненты органического и неорганического происхождения. Данный метод позволяет предотвратить появление ржавчины на определенное время, однако позже придется обновлять покрытие.
Электрозащита представляет собой процесс, при котором металлическая конструкция подключается к внешнему источнику постоянного электрического тока. В результате этого на ее поверхности формируется поляризация электродов катодного типа, и все анодные области начинают преобразовываться в катодные.
Катодная защита от коррозии необходима в тех ситуациях, когда у металла, подлежащего защите, не наблюдается предрасположенность к пассивации. К металлическому изделию подключается источник внешнего тока – специальная станция катодной защиты. Данный метод подходит для защиты газопроводов, а также трубопроводов водоснабжения и отопления. Однако есть у этого метода определенные недостатки в виде растрескивания и разрушения защитных покрытий – это происходит в случаях значительного смещения потенциала объекта в отрицательную сторону.
Способ №2
Электроискровая обработка металлов может осуществляться при помощи установок различных типов – бесконтактной, контактной, а также анодно-механической.
Способ №3
Для надежной защиты газопроводов и других трубопроводов от ржавчины часто применяется такой метод, как электродуговое напыление. Преимущества данного способа очевидны:
- значительная толщина защитного слоя;
- высокий уровень производительности и надежности;
- применение относительно недорогого оборудования;
- несложный технологический процесс;
- возможность применения автоматизированных линий;
- невысокие энергетические затраты.
Среди недостатков данного метода – невысокая эффективность при обработке конструкций в коррозийных средах, а также недостаточная прочность сцепления со стальной основой в некоторых случаях. В любых других ситуациях такая электрозащита очень эффективна.
Способ №4
Для защиты разнообразных металлических конструкций – газопроводов, мостовых сооружений, всевозможных трубопроводов – требуется эффективная антикоррозийная обработка.
Данная процедура осуществляется в несколько этапов:
- тщательное удаление жировых отложений и масел с применением эффективных растворителей;
- очистка обрабатываемой поверхности от солей, растворимых в воде, – выполняется при помощи профессиональных аппаратов высокого давления;
- удаление имеющихся конструкционных погрешностей, выравнивание кромок – это необходимо для предотвращения сколов наносимого лакокрасочного покрытия;
- тщательная очистка поверхности при помощи пескоструйного аппарата – это делается не только для удаления ржавчины, но и для придания нужной степени шероховатости;
- нанесение противокоррозийного материала и дополнительного защитного слоя.
Правильная предварительная обработка газопроводов и всевозможных металлоконструкций обеспечит им надежную защиту от электрохимической коррозии в процессе эксплуатации.
Источник
Механический способ удаления ржавчины
Для механической очистки принято использовать абразивы. Например: с помощью железной щётки можно убрать ржавчину на поверхности кузова. Недостаток: требуется много времени и сил для очистки всего кузова автомобиля вручную. Чтобы упростить себе жизнь можно воспользоваться шлифовальной машиной. При помощи шлиф-диска нужно зачистить очаги коррозии на 6–8 мм, а после зачистить мелкозернистой шкуркой до полной гладкости.

Для очистки больших металлических объектов лучше использовать пескоструйные аппараты – на «зараженный» участок под давлением подается смесь из песка и воды, которая эффективно борется с ржавчиной. При работе необходимо контролировать давление, с которым смесь воздействует на металл, поскольку при чрезмерно сильном напоре может деформироваться кузов.
Ознакомиться с технологией удаления ржавчины с поверхности кузова можно на видео:
Не стоит сбрасывать со счетов и механические факторы
Важно понимать, что многие конструкции из металла используются под постоянным напряжением. К этой категории относится повышенное внутреннее напряжение, когда сильно увеличивается риск деформации
К этой категории относится повышенное внутреннее напряжение, когда сильно увеличивается риск деформации.
Такой фактор оказывает значительное влияние на интенсивность распространения повреждения.
Даже если само сырье первоначально обладало стойкостью к потенциальным повреждениям, в таком случае она уменьшится – формируемые пленки просто не будут закрепляться на поверхности.
Потому лучше сразу исключить это условие электрохимической коррозии – постараться не использовать металлоконструкции под пиковыми сильными нагрузками, не допускать возникновения трения и соприкосновения между собой стальных деталей.
Какие механизмы отвечают за протекание электрохимической коррозии
Такое повреждение металла проводится двумя механизмами – гомогенным и гетерогенным. Рассмотрим каждый из них подробно.
- Гомогенный. Первоначально затрагивается поверхностный слой металлического изделия. Постепенно металл начинает растворяться под действием актов – катодного или анодного. На протяжении определенного времени происходит миграция катода и анода. Со временем процесс ускоряется. Особенность гомогенного механизма в том, что затрагивает как твердые, так и жидкие металлы. Меняется только скорость течения.
- Гетерогенный. У большинства твердых металлов не наблюдается гомогенной поверхности. Это связано с тем, что в самом материале состав кристаллической решетки может отличаться. Также как и в описанном выше случае, формируется анодный и катодный процессы, металл начинает постепенно разрушаться.
У такого вида процесса есть несколько особенностей.
В первую очередь – четкое деление на катодный и анодный процесс. Один из основных факторов, влияющих на их скорость протекания относительно друг друга – это время.
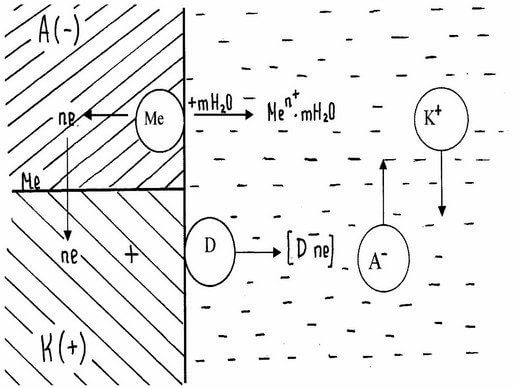
Схема электрохимической коррозии
В зависимости от типа металла, коррозия может быть локализована на отдельных участках. Также наблюдается растворение поверхностного слоя на анодах, что позволяет поражению затронуть обширные площади.
Здесь появляется еще одна особенность протекания процесса – формирование гальванических элементов. Это происходит из-за специфики структуры поверхности, на которой присутствуют микроэлектроды.






























