Классификация коррозии по характеру коррозионных поражений
- сплошная или общая коррозия;
- местная коррозия;
Местная коррозия подразделяется на:
- пятнистая;
- язвенная;
- точечная;
- сквозная;
- нитевидная;
- подповерхностная (данный вид коррозии начинается с поверхности, но распространяется преимущественно под поверхностью металла, вызывая его вспучивание и расслоение);
- межкристаллитная (разрушения сосредоточены по границе зерен металла);
- избирательная коррозия (характерна для сплавов, коррозионному воздействию подвергаются отдельные компоненты сплава);
- внутрикристаллитная (транскристаллитная) коррозия;
- коррозионное растрескивание (наблюдается при одновременном воздействии коррозионной среды и механических напряжений);
Как провести обработку своими руками?
Существуют различные способы защиты металла от коррозии, которые можно применять в домашних условиях. Для них не требуется применение дорогого оборудования и мощных химических составов.
Подготовка к обработке металла
Защитные краски
Краски, которые используются для защиты металлов, можно разделить на несколько видов:
- эпоксидные;
- алкидные;
- акриловые.
У лакокрасочных материалов есть ряд преимуществ:
- защитные составы быстро высыхают;
- для нанесения не нужно обладать дополнительными навыками;
- покрытие изменяет цвет металла;
- долговечность.
Стандартная схема антикоррозийной обработки
Защита металлоконструкций от коррозии — это технологический процесс, который требует соблюдения этапов работы. Наносится защитный слой после финишной обработки металла. Этапы нанесения защиты:
- обрабатываемая поверхность очищается от ржавчины, грязи, налёта;
- после очистки заготовка обезжиривается;
- когда обезжиривание закончено, наносится слой грунта;
- после высыхания грунта наносится два слоя защитного состава.
При проведении работ нужно пользоваться защитными очками, респиратором и перчатками.
Нормы и правила СНиП
На государственных предприятиях защита от коррозии считается важнейшим моментом, который утверждается официальным документом СНиП 2.03.11 — 85. В нём указываются такие методы защиты металла:
- покрытие лакокрасочными материалами;
- пропитка заготовки антикоррозийным составом;
- оклейка специальными плёнками.
В документе указывается какие методы можно использовать в определённых средах. При самостоятельной антикоррозийной обработке нужно учитывать правила и рекомендации из официального документа.
Антикоррозийная обработка применяется для защиты металлических изделий и продления их долговечности. При выборе защитного раствора нужно учитывать сферу эксплуатации детали.
Разрушительные процессы на меди
Медь считается достаточно стабильным металлом. Ее стабильность замечена в следующих средах:
- Атмосфера.
- Морская и пресная вода.
- Галогеновые среды со специальными условиями.
- В кислотах-неокислителях.
При этом медные конструкции отличаются нестабильностью в следующих условиях:
- При контакте с соединениями серы, а также с самой серой в чистом виде.
- При погружении в растворы солей-окислителей.
- В агрессивной воде.
Также часто встречается и атмосферная коррозия меди.
Ржавление железа
Еще один популярный элемент, который часто подвергается действию ржавчины — железо. Чаще всего железо подвергается разрушительным процессам в результате контакта с воздухом или кислотным раствором.
ВОДОРОДНАЯ И КИСЛОРОДНАЯ КОРРОЗИЯ
Коррозия металлов часто подразделяется на водородную и кислородную.
Если происходит восстановление ионов H3O+ или молекул воды H2O, говорят о водородной коррозии, или коррозии с водородной деполяризацией. Восстановление ионов происходит по следующей схеме:

Если водород не выделяется, что часто происходит в нейтральной или сильнощелочной среде, происходит восстановление кислорода и возникает кислородная коррозия, или коррозия с кислородной деполяризацией:
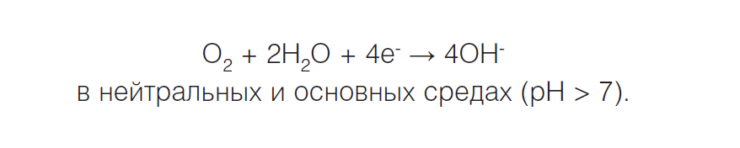
Коррозионный элемент может образовываться не только при соприкосновении двух различных металлов, но и в случае использования одного металла, если, к примеру, структура его поверхности неоднородна.
Исходя из того, что возникновение коррозии возможно только при уменьшении энергии поверхностных сил в том или другом материале, возможность коррозии с водородной и кислородной деполяризацией может быть установлена с помощью формулы, связывающей энергию Гиббса и напряжение гальванического элемента:
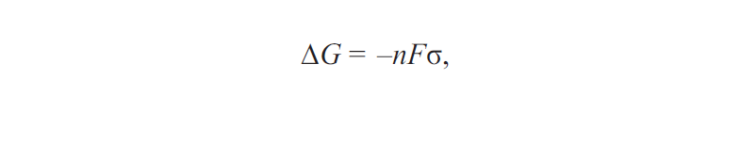
где G — энергия Гиббса; n — напряжение гальванического элемента; F — площадь гальванического элемента; σ — коэффициент, зависящий от материала гальванического элемента.
Коррозия возможна при условии, если ΔG < 0.
В зависимости от величины потенциала металла по отношению к потенциалу водородного или кислородного электрода, металлы можно разделить на три группы.
Если потенциал металла отрицательнее потенциала водородного электрода, то возможна коррозия как с поглощением кислорода, так и с выделением водорода. К таким металлам относятся щелочные и щелочноземельные металлы: Al, Zn и др.
Если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода, то коррозия возможна с поглощением кислорода и невозможна с выделением водорода. К этим металлам относятся Cd, Ni, Sn и др. Если потенциал металла положительнее потенциа ла кислородного электрода, то коррозия металла невозможна. Это — благородные металлы, например Au, Ag, Pt.
Способы защиты металлов от коррозии
Предотвращение начала или активного протекания коррозии – более удачный способ избавиться от проблем с разрушением металлов, чем постоянная замена или восстановление деталей. Поэтому все производители металлических изделий уделяют максимум внимания разработке и совершенствованию способов защиты своей продукции от ржавления.
На данный момент есть четыре основных направления:
- изменение свойств металла введением добавок. По этому принципу изготавливаются нержавеющие стали – добавки хрома (12%) повышают стойкость сплава к коррозии до почти полной невосприимчивости в нормальных бытовых условиях. Изменения температуры и состава окружающей среды снижают стойкость нержавеющей стали к коррозии;
- использование защитных покрытий. Применяются различные (в чистом виде и комбинациях) лако-красочные, эмалевые, полимерные составы. Также – и с большим успехом – используется поверхностное нанесение менее активных химически металлов (оцинковывание, хромирование, никелирование, золочение);
- применение небольших элементов (пластинок, заклепок) из более активных металлов для сохранения основного объема и массы изделия – коррозии в этом случае подвергаются именно добавленные элементы. Отдельно можно выделить создание слабого тока в самом изделии для нейтрализации тока электрохимической коррозии. Применение этого способа ограничено определенными условиями эксплуатации;
- введение ингибиторов – веществ, угнетающих процесс коррозии – в окружающую изделие среду.
Последний метод требует отдельного рассмотрения.
Проверьте себя
-
Что такое коррозия?
-
Где в повседневной жизни можно встретить ржавление железа и других металлов? Приведите примеры.
-
Гидроксид железа Fe(OH)3 называют:
а ржавчина;
б) окалина;
в) патина.
-
Что является причиной возникновения коррозии?
-
Чем отличаются химический и электрохимический типы коррозии?
-
Что такое коррозионная среда?
Узнайте все о коррозии металлов и разберитесь в других темах за 9 класс на онлайн-курсах по химии в Skysmart! Наши преподаватели помогут выяснить, где скрываются пробелы в знаниях, и восполнить их. Никаких скучных задач и сухих лекций — только интерактивные упражнения, опыты и теория простым языком. Все это поможет разобраться даже в тех темах, которые не давались в школе. Ждем на бесплатном вводном уроке!
Меры защиты от электрической коррозии
Для предотвращения этого типа коррозии используются способы электрической защиты кабеля, которые также применяют и для защиты от химической коррозии.
Суть электрической защиты заключается в подаче отрицательного потенциала на металлическую оболочку кабеля, что позволяет прекратить на ее поверхности электролитические процессы.
Электрическую защиту подразделяют на три типа:
- катодная;
- протекторная;
- дренажная.
При катодной защите земля работает как катод. Между оболочкой кабеля и грунтом при помощи специальной катодной станции прикладывается разница потенциалов, что приводит к возникновению постоянного тока. Его протекание от почвы на кабель обеспечивает поляризацию.
Протекторная защита от коррозии не требует использования внешнего источника поляризационного тока. В качестве него используется гальванический элемент, который формируется металлической оболочкой кабеля («катод») и специальным металлическим элементом («анод»). Между ними в среде электролита возникает разница потенциалов. В результате протекания поляризационного тока происходит реакция восстановления металла кабельной оболочки и окисления протектора. Для защиты металлической оболочки кабелей от коррозии в зоне действия блуждающих токов промышленной частоты используются не обычные, а поляризованные протекторы. Их особенностью является подключение к кабельной оболочке через диод.
Электрический дренаж — это способ защиты кабеля от коррозии, предусматривающий отвод блуждающих токов при помощи проводника. Дренажный проводник подключается к металлической оболочке кабеля в центральной части анодной зоны, где накапливается наиболее значительный потенциал по отношению к земле. По этому проводнику блуждающие токи отводятся к минусовой шине подстанции или к рельсам.
Классификация коррозии по характеру коррозионных поражений
- сплошная или общая коррозия;
- местная коррозия;
Местная коррозия подразделяется на:
- пятнистая;
- язвенная;
- точечная;
- сквозная;
- нитевидная;
- подповерхностная (данный вид коррозии начинается с поверхности, но распространяется преимущественно под поверхностью металла, вызывая его вспучивание и расслоение);
- межкристаллитная (разрушения сосредоточены по границе зерен металла);
- избирательная коррозия (характерна для сплавов, коррозионному воздействию подвергаются отдельные компоненты сплава);
- внутрикристаллитная (транскристаллитная) коррозия;
- коррозионное растрескивание (наблюдается при одновременном воздействии коррозионной среды и механических напряжений);
Коррозия некоторых металлов
Коррозия меди
Одним из ключевых химических элементов для отечественной промышленности является медь. Металл также подвержен деструкции, как и другие металлические поверхности, хотя медь больше защищена от коррозии.
Даже столь стойкий к разрушениям элемент подвержен негативным изменениям при воздействии окружающей среды. Коррозия меди имеет высокий показатель ухудшения свойств металла в аэрированных растворах, содержащих ионы, образовывающие комплексы с красным металлом, окислительных кислотах.
Медь стабильна в следующих условиях:
- в атмосферной среде;
- в морской и пресной водах;
- контактируя с галогенами в специальных условиях;
- в кислотах-неокислителях, слабых растворах Н3РО4, Н2SO4.
Медь нестабильна в следующих условиях:
- в ряде соединений серы, в том числе сероводороде, чистой сере;
- в кислотах-окислителях, аэрированной неокислительной среде, концентрате Н2SO4, например:
- растворах солей-окислителей тяжелых металлов, как то Fe2(SO4)3, FeCl3;
- агрессивной воды, аэрированной воды;
- амина, NH4OH.
Атмосферная коррозия меди:
2Cu+H2O+CO2+O2→ CuCO3*Cu(OH)2
Коррозия железа
Еще один распространенный элемент, подверженный ржавлению от коррозии – железо. Наибольший процент реакций по возникновению ржи на железе припадает на реакции по его окислению воздухом или кислотами из растворов.
При химической коррозии электроны переходят на окислитель, окисление металлов показано наглядно:
3Fe+2O2→Fe3O4
Электрохимическая коррозия протекает в условиях токовой проводимости. Пример атмосферной и грунтовой реакции:
Fe+O2+H2O→Fe2O3∙xH2O
Виды коррозии металлов
Учитывая сложность процесса и его многообразие, классификация видов коррозии ведется по нескольким группам признаков:
- механизм – химический или электрохимический;
- окружающая среда. Выделяют общую газовую, атмосферную (с наиболее активным действием кислорода), электролитную и неэлектролитную, подземную (иначе почвенную), биологическую среды. Также агрессивной средой считаются блуждающие токи;
- условия протекания. С погружением, без погружения и частичным погружением в среду, с непосредственным контактом, через щель, в результате трения. Выделяют межкристаллитное воздействие (по границам кристаллов и зон), коррозию под постоянным или переменным электрическим напряжением;
- степень разрушения объекта. Коррозия может быть сплошной, захватывающей всю поверхность объекта (равномерной, неравномерной, избирательной) или локальной. В этом случае отмечают пятна, язвы, точки и сквозные поражения, а также межкристаллитный вариант.
Несколько примеров для лучшего понимания сути и разновидностей коррозии.
- Повреждение днища автомобиля. Считается химическим, с активным действием влаги и атмосферного кислорода, активных газов выхлопа, дорожной «химии» и частично моющих средств при помывке авто. В случае пробоя электропроводки на днище могут воздействовать слабые токи, в этом случае коррозия будет уже электрохимической и заметно ускорится.
- Ржавление гвоздей и другого крепежа из сплавов железа в строительных конструкциях. Химический процесс, связан с атмосферной влагой и кислородом. При повышенной кислотности материала, в котором установлен крепеж, или увеличении кислотности атмосферных осадков и газовой среды ржавление усиливается и проходит быстрее.
- Сваи в морской воде. Активное воздействие агрессивного электролита (которым является морская вода) приводит к быстрому разрушению металлических конструкций. Скорость коррозии усиливают перепады температуры и механическое воздействие волн.
- Поверхностное разрушение сантехнических устройств и радиаторов отопления. Это характерный пример электрохимической коррозии, где в роли электролита выступает водопроводная вода (теплоноситель в отопительной системе) и моющие средства для сантехники.
Последний вариант (на фото) – это именно коррозия, но не ржавление, поскольку сплав, как правило, создается не на основе железа.
Способы защиты металлов от коррозии
Предотвращение начала или активного протекания коррозии – более удачный способ избавиться от проблем с разрушением металлов, чем постоянная замена или восстановление деталей. Поэтому все производители металлических изделий уделяют максимум внимания разработке и совершенствованию способов защиты своей продукции от ржавления.
На данный момент есть четыре основных направления:
- изменение свойств металла введением добавок. По этому принципу изготавливаются нержавеющие стали – добавки хрома (12%) повышают стойкость сплава к коррозии до почти полной невосприимчивости в нормальных бытовых условиях. Изменения температуры и состава окружающей среды снижают стойкость нержавеющей стали к коррозии;
- использование защитных покрытий. Применяются различные (в чистом виде и комбинациях) лако-красочные, эмалевые, полимерные составы. Также – и с большим успехом – используется поверхностное нанесение менее активных химически металлов (оцинковывание, хромирование, никелирование, золочение);
- применение небольших элементов (пластинок, заклепок) из более активных металлов для сохранения основного объема и массы изделия – коррозии в этом случае подвергаются именно добавленные элементы. Отдельно можно выделить создание слабого тока в самом изделии для нейтрализации тока электрохимической коррозии. Применение этого способа ограничено определенными условиями эксплуатации;
- введение ингибиторов – веществ, угнетающих процесс коррозии – в окружающую изделие среду.
Последний метод требует отдельного рассмотрения.
Виды коррозии и ее причины
Перед тем как говорить о ржавчине на железе, кратко рассмотрим другие ее типы.
Коррозии подвержены не только металлы, но и неметаллические изделия. В этом случае коррозию еще называют «старением». Старению подвержены пластмассы, резины и другие вещества. Для бетона и железобетона существует термин «усталость». Происходит их разрушение или ухудшение эксплуатационных характеристик из-за химического и физического воздействия окружающей среды. Корродируют и металлические сплавы — медь, алюминий, цинк: в процессе их коррозии на поверхности изделий образуется оксидная пленка, плотно прилегающая к поверхности, что значительно замедляет дальнейшее разрушение металла (а патина на меди еще и придает ей особый шарм). Драгоценные металлы являются таковыми не только из-за своей красоты, ценимой ювелирами, но и за счет стойкости к коррозии. Золото и серебро до сих пор используется для покрытия особо чувствительных электронных контактов а платина применяется в космической отрасли.
Корродировать металл может в некоторых участках поверхности (местная коррозия), охватить всю поверхность (равномерная коррозия), или же разрушать металл по границам зерен (межкристаллитная коррозия). Коррозия заметно ускоряется с повышением температуры.

Основные внешние факторы электрохимической коррозии
Кроме внутренних, на металл также влияют и внешние факторы.
Они могут не только ускорять, но и замедлять процесс, а также влиять на характер его протекания.
К ним относятся следующие:
Температура. Температура сильно влияет на то, как себя ведет металл в разных условиях. От нее сильно зависит то, насколько быстро будут растворяться вторичные продукты коррозии. Среди других особенностей – запуск и стимуляция диффузионных процессов в металле, создание перенапряжения на электродах и другие проявления. Когда металлическое изделие помещается в растворы с кислородной деполяризацией, по мере прогрева электролита диффузия окислителя ускоряется. На фоне этого наблюдается сильное снижение перенапряжения ионизации кислорода.
Если деталь помещается в растворы неокисляющихся кислот, наблюдается коррозия с водородной деполяризацией.
Отдельно стоит отметить ситуацию, когда металл уже покрывается специальной защитной пленкой. В этом случае сам тип пленки будет влиять на то, как именно она поведет себя при контакте с разными видами внешних угроз, в том числе, с повышением температуры.
Нагрев и охлаждение могут отразиться на состоянии катодов и анодов через их внутренние процессы.
В некоторых случаях полярность электродов значительно меняется.
Как мы уже отмечали выше, проблемы могу возникать из-за того, что разные участки детали нагреты до отличающихся друг от друга температур.
В этом случае стремительно увеличивается количество термогальванических пар, стимулирующих распространение коррозии на новые участки.
Уровень рН раствора, в который помещен металл. Такой показатель как рН указывает, насколько в растворе будут активными ионы водорода, и как быстро коррозия будет распространяться по материалу. Это опасно, потому что может непредсказуемо менять потенциал катодных процессов, формирование окисных пленок. Также создается значительное перенапряжение реакции на электродах. Рекомендуется не допускать контакта металла со средами, у которых показатель рН высокий.
Если по каким-то причинам металлическая заготовка оказалась помещена в раствор, большое значение будет иметь скорость, с которой он движется, а также само наличие внутренних колебаний.
Заранее определить точное воздействие будет сложно по той причине, что всегда непросто предсказать, как поведут себя нейтральные электролиты.
Cчитается, что при смешении электролита, меняются показатели диффузии кислорода, что значительно отражается на процессе протекания коррозии.
Можно уделять меньше внимания скорости движения электролита в том случае, если вы имеете дело со средами повышенной кислотности.
На них подобное поражение оказывает минимум влияния.
Разновидность металлов по отношению к коррозии электрохимического вида
Все металлы по отношению к такому виду ржавчины делятся на 4 подтипа:
- Активные вещества или материалы с высокими параметрами термодинамической нестабильности. Это все щелочные виды металлов. Они подвержены влиянию коррозии даже в абсолютно нейтральных средах, где нет кислорода и других окислительных веществ.
- Средние материалы по уровню активности — в таблице Менделеева расположены между кадмием и водородом. Это материалы отличающиеся термодинамической нестабильностью в агрессивных кислых средах.
- Материалы с низкими параметрами активности или вещества с промежуточными параметрами стабильности по термодинамике. Противостоят коррозии в кислых и нейтральных атмосферах, при отсутствии кислорода.
- Благородные разновидности веществ. Это материалы с высокой стабильностью. Они поддаются коррозии только в кислых средах и в присутствии сильнейших окислителей.
Такие типы ржавчины могут разделяться по видам агрессивных сред, в которой она протекает:
- Процесс в электролитных веществах — процесс протекает в жидких кислых, щелочных средах, а также в простой воде.
- Атмосферный вид — любой газовый вариант с наличием влажности. Это очень распространенный вариант электрохимического разрушения металла. Главное, чтобы в данной среде была влажность. Только при таких условиях есть возможность протекания необходимых реакций.
При электрохимической вариации процесса одна часть металла служит анодом, а другая — катодом. Последним становятся те участки металла, куда больше поступает кислорода.
В зависимости от воздействующих сред есть и другие разновидности коррозий:
- Почвенная — протекает с разной степенью интенсивности. Все зависит от агрессивности почвы. В таких условиях происходит подземные разрушительные процессы на трубах и прочих подземных конструкциях.
- Аэрационная — причиной служит неравномерный приток воздуха к разным участкам материала.
- Морская — процесс проходит строго в соленой воде.
- Биокоррозия — результат жизнедеятельности бактерий и микроорганизмов. Они выделяют газы, которые и приводят к возникновению разрушительных процессов.
- Электрокоррозия — является результатом воздействия блуждающего тока.
Кроме того основные виды коррозии могут различаться в зависимости от типа металла, на которых они возникают.
Прямые и косвенные проблемы, связанные с коррозией металла
Основная беда коррозии – постепенное разрушение корродировавших частей конструкций и изделий. При этом степень повреждение по внешнему виду можно оценить не всегда, и потеря прочности становится неожиданной и критичной.
Особенно сильно действует межкристаллическая, то есть проходящая по границам кристаллов, коррозия. Внешне процесс может быть совершенно незаметен, в то время как уровень потери прочности достигает уже 50…60%.
Наименьшее воздействие на прочностные свойства изделий оказывает поверхностное разрушение.
На фото показана часть конструкций башни Шухова в Москве. Поверхностное ржавление существенно снизило конструктивную прочность, но не привело к разрушению сооружения (пока)
Оценить уровень потерь от коррозии металла крайне сложно. Дело даже не в непосредственных убытках от разрушения корродировавших деталей или конструкций, а в простоях техники и сооружений и нарушениях их работоспособности в целом, связанных с коррозионным разрушением отдельных элементов.
Разновидность металлов по отношению к коррозии электрохимического вида
Все металлы по отношению к такому виду ржавчины делятся на 4 подтипа:
- Активные вещества или материалы с высокими параметрами термодинамической нестабильности. Это все щелочные виды металлов. Они подвержены влиянию коррозии даже в абсолютно нейтральных средах, где нет кислорода и других окислительных веществ.
- Средние материалы по уровню активности — в таблице Менделеева расположены между кадмием и водородом. Это материалы отличающиеся термодинамической нестабильностью в агрессивных кислых средах.
- Материалы с низкими параметрами активности или вещества с промежуточными параметрами стабильности по термодинамике. Противостоят коррозии в кислых и нейтральных атмосферах, при отсутствии кислорода.
- Благородные разновидности веществ. Это материалы с высокой стабильностью. Они поддаются коррозии только в кислых средах и в присутствии сильнейших окислителей.
Такие типы ржавчины могут разделяться по видам агрессивных сред, в которой она протекает:
- Процесс в электролитных веществах — процесс протекает в жидких кислых, щелочных средах, а также в простой воде.
- Атмосферный вид — любой газовый вариант с наличием влажности. Это очень распространенный вариант электрохимического разрушения металла. Главное, чтобы в данной среде была влажность. Только при таких условиях есть возможность протекания необходимых реакций.
При электрохимической вариации процесса одна часть металла служит анодом, а другая — катодом. Последним становятся те участки металла, куда больше поступает кислорода.
В зависимости от воздействующих сред есть и другие разновидности коррозий:
- Почвенная — протекает с разной степенью интенсивности. Все зависит от агрессивности почвы. В таких условиях происходит подземные разрушительные процессы на трубах и прочих подземных конструкциях.
- Аэрационная — причиной служит неравномерный приток воздуха к разным участкам материала.
- Морская — процесс проходит строго в соленой воде.
- Биокоррозия — результат жизнедеятельности бактерий и микроорганизмов. Они выделяют газы, которые и приводят к возникновению разрушительных процессов.
- Электрокоррозия — является результатом воздействия блуждающего тока.
Кроме того основные виды коррозии могут различаться в зависимости от типа металла, на которых они возникают.
Виды коррозии
Как уже говорилось, критериев классификация коррозионных процессов существует множество. Так, различают коррозию по виду распространения (сплошная, местная), по типу коррозионной среды (газовая, атмосферная, жидкостная, почвенная), по характеру механических воздействий (коррозионное растрескивание, явление Фреттинга, кавитационная коррозия) и так далее.
Но основным способом классификации коррозии, позволяющим наиболее полно объяснить все тонкости этого процесса, является классификация по механизму протекания.
По этому критерию различают два вида коррозии:
- химическую
- электрохимическую
Химическая коррозия
Химическая коррозия отличается от электрохимической тем, что протекает в средах, не проводящих электрический ток. Поэтому при такой коррозии разрушение металла не сопровождается возникновением электрического тока в системе. Это обычное окислительно-восстановительное взаимодействие металла с окружающей средой.
Наиболее типичным примером химической коррозии является газовая коррозия. Газовую коррозию еще называют высокотемпературной, поскольку обычно она протекает при повышенных температурах, когда возможность конденсации влаги на поверхности металла полностью исключена. К такому виду коррозии можно отнести, например, коррозию элементов электронагревателей или сопел ракетных двигателей.
Скорость химической коррозии зависит от температуры — при ее повышении коррозия ускоряется. Из-за этого, например, в процессе производства металлического проката, во все стороны от раскаленной массы разлетаются огненные брызги. Это с поверхности металла скалываются частички окалины.
Окалина — типичный продукт химической коррозии, — оксид, возникающий в результате взаимодействия раскаленного металла с кислородом воздуха.
Помимо кислорода и другие газы могут обладать сильными агрессивными свойствами по отношению к металлам. К таким газам относятся диоксид серы, фтор, хлор, сероводород. Так, например, алюминий и его сплавы, а также стали с высоким содержанием хрома (нержавеющие стали) устойчивы в атмосфере, которая содержит в качестве основного агрессивного агента кислород. Но картина кардинально меняется, если в атмосфере присутствует хлор.
В документации к некоторым антикоррозионным препаратам химическую коррозию иногда называют «сухой», а электрохимическую — «мокрой». Однако химическая коррозия может протекать и в жидкостях. Только в отличие от электрохимической коррозии эти жидкости — неэлектролиты (т.е. не проводящие электрический ток, например спирт, бензол, бензин, керосин).
Примером такой коррозии является коррозия железных деталей двигателя автомобиля. Присутствующая в бензине в качестве примесей сера взаимодействует с поверхностью детали, образуя сульфид железа. Сульфид железа очень хрупок и легко отслаивается, освобождая свежую поверхность для дальнейшего взаимодействия с серой. И так, слой за слоем, деталь постепенно разрушается.
Электрохимическая коррозия
Если химическая коррозия представляет собой не что иное, как простое окисление металла, то электрохимическая — это разрушение за счет гальванических процессов.
В отличие от химической, электрохимическая коррозия протекает в средах с хорошей электропроводностью и сопровождается возникновением тока. Для «запуска» электрохимической коррозии необходимы два условия: гальваническая пара и электролит.
В роли электролита выступает влага на поверхности металла (конденсат, дождевая вода и т.д.). Что такое гальваническая пара? Чтобы понять это, вернемся к ряду активности металлов.
Смотрим. Cлева расположены более активные металлы, справа — менее активные.
Если в контакт вступают два металла с различной активностью, они образуют гальваническую пару, и в присутствии электролита между ними возникает поток электронов, перетекающих от анодных участков к катодным. При этом более активный металл, являющийся анодом гальванопары, начинает корродировать, в то время как менее активный коррозии не подвергается.
Схема гальванического элемента
Для наглядности рассмотрим несколько простых примеров.
Допустим, стальной болт закреплен медной гайкой. Что будет корродировать, железо или медь? Смотрим в ряд активности. Железо более активно (стоит левее), а значит именно оно будет разрушаться в месте соединения.
Стальной болт — медная гайка (корродирует сталь)
А если гайка алюминиевая? Снова смотрим в ряд активности. Здесь картина меняется: уже алюминий (Al), как более активный металл, будет терять электроны и разрушаться.
Таким образом, контакт более активного «левого» металла с менее активным «правым» усиливает коррозию первого.
Почему коррозия называется коррозией?
Слово коррозия происходит от латинского «corrodo» – «грызу». Некоторые источники ссылаются на позднелатинское «corrosio» – «разъедание». Не следует путать понятия «коррозия» и «ржавчина». Если коррозия – это процесс, то ржавчина один из его результатов. Это слово применимо только к железу, входящему в состав стали и чугуна. В дальнейшем под термином «коррозия» мы будем подразумевать коррозию металлов. Согласно международному стандарту ISO 8044 под коррозией понимают физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функциональных свойств металла (сплава), среды или включающей их технической системы. РЖАВЧИНА – это слой частично гидратированных оксидов железа, образующийся на поверхности железа и некоторых его сплавов в результате коррозии. Коррозионному разрушению подвержены также бетон, строительный камень, дерево, другие материалы; коррозия полимеров называется деструкцией.
Среда, в которой металл подвергается коррозии (корродирует) называется коррозионной или агрессивной средой. В случае с металлами, говоря об их коррозии, имеют ввиду нежелательный процесс взаимодействия металла со средой.
Физико-химическая сущность изменений, которые претерпевает металл при коррозии, является окисление металла. Любой коррозионный процесс является многостадийным:
- Необходим подвод коррозионной среды или отдельных ее компонентов к поверхности металла.
- Взаимодействие среды с металлом.
- Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая).
Известно, что большинство металлов (кроме Ag, Pt ,Cu, Au) встречаются в природе в ионном состоянии: оксиды, сульфиды, карбонаты и др., называемые обычно рудами металлов. Ионное состояние более выгодно, оно характеризуется меньшей внутренней энергией. Это заметно при получении металлов из руд и их коррозии. Поглощенная энергия при восстановлении металла из соединений свидетельствует о том, что свободный металл обладает более высокой энергией, чем металлическое соединение. Это приводит к тому, что металл, находящийся в контакте с коррозионно-активной средой стремится перейти в энергетически выгодное состояние с меньшим запасом энергии. То есть можно сказать, что первопричиной коррозии является термодинамическая неустойчивость системы, состоящей из металла и компонентов окружающей (коррозионной) среды. Мерой термодинамической неустойчивости является свободная энергия, освобождаемая при взаимодействии металла с этими компонентами. Но свободная энергия сама по себе ещё не определяет скорость коррозионного процесса, т. е. величину, наиболее важную для оценки коррозионной стойкости металла. В ряде случаев адсорбционные или фазовые слои (плёнки), возникающие на поверхности металла в результате начавшегося коррозионного процесса образуют настолько плотный и непроницаемый барьер, что коррозия прекращается или очень сильно тормозится. Поэтому в условиях эксплуатации металл, обладающий большим сродством к кислороду, может оказаться не менее, а более стойким (так, свободная энергия образования окисла у Cr или Al выше, чем у Fe, а по стойкости они часто превосходят Fe).






























