Сфера применения
Интересно то, где применяется ртуть. Несмотря на высокую токсичность, вещество получило широкое применение. Вот основные области, в которых применяется металл:
- Медицина. Раньше ртуть добавляли в различные лекарственные препараты. Но из-за высокой токсичности лекарства на основе ртути запретили. Теперь ее используют только для консервации некоторых вакцин и в термометрах. Но до 70-х годов 20 века ртуть применяли в медицине очень активно. Например, изготавливали слабительные, мочегонные средства и антисептики.
- Техника. Ртуть используют для ртутных термометров, заполняют ею люминесцентные лампы. Ее используют в датчиках положения, в герметичных выключателях, в некоторых источниках тока.
- Металлургия. Металлическая ртуть используется для изготовления различных сплавов. Амальгамы золота и серебра раньше использовались в ювелирном деле и при покрытии зеркал. Но из-за высокой токсичности их стали использовать реже. Ртуть отлично смачивает золото, поэтому ее используют при золотодобыче.
- Химическая промышленность. Соли ртути используют при промышленном получении ацетальдегида из ацетилена. Также часто используется реактив Несслера – тетраиодомеркурат калия.
- Сельское хозяйство. Некоторые соединения ртути используют для протравливания зерна и в качестве пестицидов. Но такие вещества очень токсичны.
Ртуть и ее соединения очень токсичны и могут нанести вред человеческому организму. Поэтому при работе с таким веществом необходимо соблюдать правила собственной безопасности – обязательно надевать перчатки и защитную маску.
Сфера применения
В медицине
До того, как стало ясно, что ртуть, её пары и соединения являются токсичными ядовитыми веществами, этот минерал в самых разнообразных видах и соединениях находил широкое применение в медицине. Вот несколько не столь давних примеров использования этого минерала в качестве лекарственного средства:
- Древние китайцы применяли её для избавления от проказы, индусы – в качестве эликсира долголетия, арабы – как средство при заболеваниях кожи и в случаях укусов разнообразных насекомых.
- Лечение заворота кишок, основанное на высоком удельном весе минерала, способного своей тяжестью их расправить, было широко распространено в средневековье.
- Европейская эпидемия сифилиса вызвала к жизни применение ртути в качестве средства избавления от тяжелого недуга. Изобретение знаменитого Парацельса (позднее на смену ему пришла каломельная мазь И. И. Мечникова) продолжало активно использоваться для лечения венерического заболевания вплоть до 70-ых годов прошлого века, когда ему на смену пришли антибиотики.
- На рубеже XIX и XX веков этот жидкий металл входил в состав антисептических, дезинфицирующих, слабительных, мочегонных, стоматологических средств. На его основе изготовлялось бактерицидное мыло.
- Однако, не смотря на своё крайне вредное воздействие на человеческий организм, ртуть нисколько не утратила своих позиций в современной медицине. Она является рабочим телом высокоточных термометров, входит в состав ряда вакцин и мазей. Мало того, с помощью этого древнейшего лечебного средства создаются средства для высокоэффективного лечения рака, СПИДа, разрабатываются препараты для защиты от радиоактивных поражений и блокировки развития опасных заболеваний.
В высокоточной измерительной технике
Жидкое агрегатное состояние ртути находит широкое применение её в качестве рабочего тела при конструировании манометров, термометров, барометров, полярографов, терморегуляторов. Она устойчива к перепадам температуры в плане своих физико-химических свойств и обладает очень низкой температурой плавления. Правда, работа с подобной техникой требует предельной аккуратности, а после истечения срока эксплуатации, приборы подлежат обязательной утилизации с извлечением ртути.

В металлургической промышленности
Одно из древнейших направлений использования ртути – это металлургия.
Так, процесс амальгамации позволяет производить комплексную переработку полиметаллических руд, что очень удобно для добычи золота, серебра, вторичной переработки алюминия. В своё время жидкие или твёрдые сплавы этого минерала с металлами стали основой производства зеркал и изделий ювелирной мастерства.
Электролиз с ртутным катодом положен в основу техпроцесса для получения хлора, щёлочи, активных в химическом отношении металлов. Современная промышленность активно использует сплавы ртути с натрием, оловом, висмутом, свинцом.
В сельском хозяйстве
Ядовитые свойства этого полезного ископаемого, способного своими парами уничтожать вредные микроорганизмы, пригодились в сельском хозяйстве. Это – прежде всего протравка семян перед посадкой, а также – борьба с болезнетворными бактериями, вредителями, паразитами и сорняками.
Хранение и транспортировка
Так как ртуть и её целый ряд химических соединений, имеющих её в своём составе, представляют угрозу для жизни и здоровья, то хранение и перевозка этого вещества чрезвычайной опасности должна производиться специально обученными лицами в предназначенной для этой процедуры таре.
Складское хранение и транспортировка ртути разрешена только в баллонах, изготовленных из чёрной стали, плотно закрывающихся снаружи и эмалированных внутри. Допускается нахождение ртути в толстостенных стеклянных ёмкостях с притёртыми пробками на рабочих местах в необходимых объёмах. Причём поверхность жидкого металла должна быть залита водой или глицерином с целью недопущения испарения вредных паров. Емкости должны располагаться на подносах внутри вытяжных шкафов. Места хранения, проведения погрузочно-разгрузочных работ и расфасовки должны быть оборудованы специальными приспособлениями и посудой.
Транспортировка этого опасного вещества должна осуществляться исключительно в небьющейся посуде. Транспорт для перевозки необходимо иметь в исправном состоянии, а водители – обладать соответствующими допусками и разрешениями.
Свойства
Ртуть — удивительный элемент. Он относится к металлам, но при нормальных условиях представляет собой тяжелую жидкость.
«Живое серебро» — металл малоактивный, в реакции с растворами кислот не вступает, но с царской водкой реагирует, как и с азотной и серной кислотами.
Характеристики ртути вызывают удивление:
При взаимодействии ртути с металлами жидкий металл образует двухъядерные катионы (Hg22+). Это редчайшее для металлов свойство.
Этот легкоплавкий металл при замораживании всего до 39°С затвердевает. Из него можно даже сковать колечко, но носить его не получится — на пальце металл «растает».
| Свойства атома | |
|---|---|
| Название, символ, номер | Ртуть / Hydrargyrum (Hg), 80 |
| Атомная масса(молярная масса) | 200,592(3) а. е. м. (г/моль) |
| Электронная конфигурация | 4f14 5d10 6s2 |
| Радиус атома | 157 пм |
| Химические свойства | |
| Ковалентный радиус | 149 пм |
| Радиус иона | (+2e) 110 (+1e) 127 пм |
| Электроотрицательность | 2,00 (шкала Полинга) |
| Электродный потенциал | Hg←Hg2+ 0,854 В |
| Степени окисления | +2, +1 |
| Энергия ионизации(первый электрон) | 1 006,0 (10,43) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 13,546 (20 °C) г/см³ |
| Температура плавления | 234,32 K (-38,83 °C) |
| Температура кипения | 629,88 K (356,73 °C) |
| Уд. теплота плавления | 2,295 кДж/моль |
| Уд. теплота испарения | 58,5 кДж/моль |
| Молярная теплоёмкость | 27,98 Дж/(K·моль) |
| Молярный объём | 14,81 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | ромбоэдрическая |
| Параметры решётки | ahex=3,464 сhex=6,708 Å |
| Отношение c/a | 1,94 |
| Температура Дебая | 100,00 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 8,3 Вт/(м·К) |
| Номер CAS | 7439-97-6 |
Металл имеет высокую плотность — 13,5 г/см3. Ведро, с налитой в него ртутью, не под силу поднять человеку — настолько оно тяжелое.
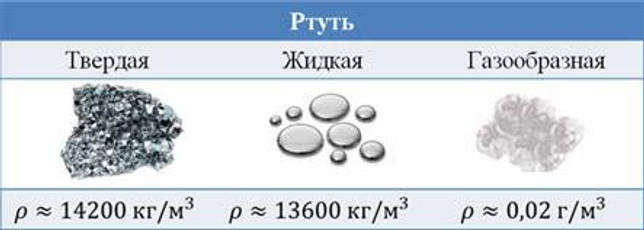
Плотность ртути при нормальных условиях — 13 546 кг/м3, при других температурах — в таблице ниже:
| Температура в °С | Плотность (ρ), 103 кг/м3 | Температура в °С | Плотность (ρ), 103 кг/м3 |
| 13,5950 | 50 | 13,4725 | |
| 5 | 13,5827 | 55 | 13,4601 |
| 10 | 13,5704 | 60 | 13,4480 |
| 15 | 13,5580 | 65 | 13,4358 |
| 20 | 13,5457 | 70 | 13,4237 |
| 25 | 13,5335 | 75 | 13,4116 |
| 30 | 13,5212 | 80 | 13,3995 |
| 35 | 13,5090 | 90 | 13,3753 |
| 40 | 13,4967 | 100 | 13,3514 |
| 45 | 13,4845 | 300 | 12,875 |
Процесс добычи руды
Добыча ртути производится в шахтах с проведением буровых и подрывных работ, применяя электротехническое оборудование и промышленную пиротехнику. Добытый красный камень, транспортируется от месторождения конвейерными лентами, затем грузовиками или поездами в пункты дальнейшей обработки руды (обогатительные фабрики, перерабатывающие заводы). Там материал измельчается на дробилках в одну или несколько стадий. Дробленую руду отправляют в специальные мельницы, чтобы получить более мелкую фракцию. Для оптимального эффекта, промышленные мельницы снабжены короткими прутками или шарами из стали.

Месторождения, добыча
Ртутные месторождения планеты исчисляются поштучно:
- Крупнейшими залежами располагает Испания.
- Запасы руды разведаны на Кавказе, Памире, Европе (Словения, Украина).
- В России зарегистрировано более двадцати месторождений, крупнейшие – на Чукотке. Национальные запасы оцениваются в 15,6 тыс. тонн.
 Словенский город Идрия — крупнейший в Европе центр добычи ртути с XV века
Словенский город Идрия — крупнейший в Европе центр добычи ртути с XV века
В природе выявлено два десятка ртутных минералов, однако промышленный интерес представляет только киноварь (сульфид с содержанием ртути 86%). Иногда рентабельна добыча самородной ртути и шватцита (до 17%).
Жидкое серебро в нашем доме
Почти в каждом доме есть ртутный градусник, и разбить его очень просто. Ртуть окажется на полу, это создаст опасность для здоровья.
Как правильно собрать шарики ртути:
- Ртуть легко «прилипает» к оловянной фольге.
- Если в доме есть азотная кислота — смочите в ней медную проволочку, и собирайте ртутные шарики в емкость (лучше стеклянную).
- Попытайтесь собрать шарики шприцем без иглы.
- Мелкие частички можно собирать скотчем.
- Обработайте место разлива раствором марганцовки или хлорной извести.
Нельзя собирать разлившийся металл веником или пылесосом.
Познавательно: если вы купили термометр, а в нем красная жидкость — не думайте, что это легендарная красная ртуть. Это просто спиртовой, а не ртутный термометр.
Это интересно: Сероводород
Процесс производства ртути из руды
Технология получения ртути из измельчённой руды, состоит из нескольких этапов:
- Обжиг. Мелкоизмельчённая руда нагревается в трубчатой печи до определённой температуры. В результате химического взаимодействия с кислородом, образуется диоксид серы и происходит испарение ртути.
- Конденсация. Получившаяся после обжига газообразная смесь, содержащая в себе ртутные испарения, двуокись серы, водяной пары и другие побочные вещества, попадает в конденсатор охлаждения. Где сама ртуть конденсируется в жидкое состояние, а оставшиеся газы и пары или находят дальнейшее применение, или выбрасываются в атмосферу.
- Консолидация и очистка. В специально определённой ёмкости ртуть накапливается и очищается от примесей, оставшихся на её поверхности. Такое становится возможным благодаря очень высокой плотности перерабатываемого минерала.
- Доочистка. Так как полученный продукт не всегда удовлетворяет требованиям последующего использования, то осуществляется трёхступенчатая доочистка, включающая:
- механическую фильтрацию,
- электролиз,
- химическую очистку активными компонентами.
Конечным результатом этих процессов выступает пригодная для дальнейшего использования ртуть, находящее применение в ряде отраслей народного хозяйства.
Где находит применение ртуть
Уникальные свойства сделали ртуть в современных отраслях промышленности важным элементом. Нет такой отрасли, где бы не использовался этот необычный металл:
- Химическая промышленность:
- самое массовое потребление ртути используется в хлорном производстве, она является катодом в электролитическом процессе получения едкого натрия и хлора;
- в качестве катализатора при образовании органических соединений;
- для растворения урановых блоков, используемых в атомной энергетике.
- при термохимической реакции разложения воды на кислород и водород в атомно-водородной энергетике.
- Металлургия:
- использует свойство ртути растворять в себе большинство металлов, в результате чего получаются амальгамы;
- целый ряд важнейших сплавов получается с помощью ртути, находящих применение в гальванопластике, гравировке и литографии;
- ртутные соединения применяют в производстве драгоценных металлов.
- Тяжёлое машиностроение:
- вакуумные установки;
- современны ртутные диффузионные насосы;
- тяжелонагруженные гидродинамические подшипники;
- ртутнопаровые турбины содержат большое количество ртути в жидком состоянии и его необходимо постоянно пополнять.
- Электротехническая промышленность:
- лампы дневного света, кварцевые, люминесцентные;
- выпрямители электрического тока, преобразующие трёхфазный ток в постоянный посредством жидкого ртутного катода;
- сухие батареи, технология изготовления которых включает применение ртути, сегодня на них работают слуховые аппараты;
- аккумуляторы.
- Приборостроение и радиотехническая промышленность:
- контрольно-измерительные приборы (манометры, ареометры, барометры, термометры), полярографы;
- ртутные муфты входят в сборку миниатюрных двигателей для стиральных машин, холодильников, кондиционеров;
- в астрономии есть ртутный прибор — горизонт, где металл выступает в роли идеальной зеркальной поверхности для наблюдения за небесными телами.
- В горном деле ртуть помогает отделить от золота неметаллические примеси.
- Нефтеперерабатывающая промышленность использует способность ртутных паров к точной регулировке температур при очистке нефти.
- Военная промышленность из ртути и её соединений получает «гремучую ртуть» — взрывчатое вещество, закладываемое в детонаторы снарядов и гранат.
- Медицина получает антисептические, противопаразитарные, мочегонные препараты ртути. Стоматология изготавливает зубные протезы и пломбы из амальгамы олова, серебра и кадмия.
- Сельское хозяйство применяет органические соединения ртути как гербициды и для протравливания семян.
- В судостроении подводную часть морских судов покрывают специальной краской, содержащей ртуть. Соединяясь с морским хлором, на покрытии днища образуется сулема, от которой вредные бактерии гибнут.
- Органические и неорганические соединения ртути находят применения в фотографии, пиротехнике, при изготовлении художественных изделий из фарфора, дублении кожи, окрашивании тканей.
Химические особенности
Металл характеризуется степенью окисления +1 и +2. В первом случае он представлен двухъядерным катионом Hg22+ с металлической связью и склонен к диспропорционированию, которое проходит при нагревании и разбавлении водой.

На холоде вещество со степенью окисления +2 и металлическая ртуть сопропорционируют. Реагируя с нитратом металла, элемент образует нитрат ртути. При степени окисления +2 получаются катионы Hg2+, которые легко гидролизуются. Гидроксид металла существует лишь в разбавленных растворах, а в жидкостях с высокой концентрацией он дегидратируется.
Запасы и добыча ртути
Металл под названием ртуть содержится в минерале киноварь. Это камень красного цвета, который издавна применялся как краситель. Также вещество может находиться и в других минералах, но в мизерном количестве. Поэтому основным источником ртути является именно киноварь. В нем содержится около 85% сульфида ртути.
Ртуть является очень ценным металлом, так как только она при комнатной температуре находится в жидком агрегатном состоянии. Нет ни одного другого вещества, который бы по свойствам был похож на ртуть. Поэтому ее добывают во всех странах.
Камни киновари могут быть крупными или по размеру с зерно. Обычно они располагаются на небольшой глубине. Металл выделяют из киновари во время нагревания. При повышенных температурах ртуть начинает выделяться из руды небольшими каплями, которые стекают в заранее подготовленные резервуары.
Где добывают ртуть? Больше всего месторождений киновари находится в Италии, Испании, Канаде, США, во многих государствах Азии. Самой богатой на ртуть страной является Испания – здесь содержится 75% мирового запаса металла. Крупнейшим месторождением является рудник Альмаден, который стали разрабатывать еще более 2000 лет назад. В России также есть месторождения ртути. В основном ее добывают на Алтае, Камчатке и Каказе.
Нахождение в природе
В России есть 23 места, где добывают ртуть. Самое крупное из них находится на Чукотке.
Металл также добывают и в других странах:
- Италия;
- Испания;
- Словения;
- Таджикистан;
- Украина;
- Киргизия.

Концентрация вещества в земной коре составляет всего 83 мг/т. Редкий металл слабо соединяется химически с иными элементами. Но ртутные руды часто бывают очень концентрированными, если их сравнивать с обычными горными породами, и могут содержать до 2,5% серебристого металла.
В основном ртуть рассеяна в природе. Лишь 0,02% от всего её объёма заключено в месторождениях. Наибольшие концентрации наблюдаются в глинистых сланцах. В Мировом океане объём вещества достигает 0,1 мкг/л.
Металл можно обнаружить во многих сульфидных минералах.
Нахождение в природе
Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В обычных условиях киноварь и металлическая ртуть не растворимы в воде, но в присутствии некоторых веществ (Fe2(SO4)3, озон, пероксид водорода) растворимость в воде этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах щелочных металлов с образованием, например, комплекса HgS•nNa2S. Ртуть легко сорбируется глинами, гидроксидами железа и марганца, глинистыми сланцами и углями.
В природе известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg). В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда — шватцит (до 17 % Hg). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb4S7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся, прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg2Cl2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения — терлингуаит Hg2ClO, эглестонит Hg4Cl.
Месторождения
Ртуть считается редким металлом.
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен), Донбассе (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
Применение ртути в современной промышленности
Благодаря своим свойствам ртуть применяется в различных отраслях промышленности:
-
Металлургической.
Амальгамы устойчивы к высоким температурам, долговечны. Сплавы металла используют для гравировки, литографии, гальванопластике. -
Химической промышленности.
Ртутные катоды применяют в производстве едкого натрия, хлора. Ртуть выступает катализатором при образовании органики. -
Атомной энергетике.
В ртути растворяют урановые блоки. Она участвует в термохимической реакции получения из воды кислорода и водорода. -
Машиностроении.
Ртутно-паровые турбины, диффузионные насосы, гидродинамические подшипники. -
Электротехнике.
Люминесцентные кварцевые светильники, выпрямители тока с жидким ртутным катодом. -
Приборостроении.
Манометры, термометры, полярографы. -
Горноперерабатывающей.
Ртуть используют для очистки золотых самородков от примесей. -
Нефтяной промышленности.
Ртутный пар помогает регулировать температуры в процессе очистки нефтяного сырья. -
Сельском хозяйстве.
Ртуть входит в состав гербицидов. -
В судостроении.
Ртутной краской красят подводную часть судна. -
В военной промышленности.
Ее включают в детонаторы, гранаты.
Несмотря на то, что ртуть широко используется в промышленности, стоит помнить о ее ядовитых свойствах. Поэтому сегодня ртуть заменяют, где это возможно, на более безопасные материалы.
Узнайте еще много нового:
Демеркуризация ртути: какие вещества используются и алгоритм
Как убрать ртуть, если разбился градусник?
Как правильно утилизировать люминесцентные лампы: контейнеры по сборы и договор на вывоз
К какому классу отходов относятся люминесцентные и ртутные лампы?
Cеребро, золото и другие драгметаллы из радиодеталей
Утилизация неисправных аккумуляторов: автомобилей, телефонов, ИБП
Как правильно утилизировать ртутный градусник в домашних условиях?
Как и чем собрать ртуть из разбитого градусника?
Как правильно утилизировать энергосберегающие лампочки?
Утилизация бактерицидных, энергосберегающих, ламп накаливания, солярия
Как правильно утилизировать разбитый градусник?
Нейтрализация ртути: чем нейтрализовать в домашних условиях?
Ртутные приборы
В ртутных приборах Hg содержится в разных количествах. Так как она ядовита, ее помещают в стеклянные емкости. Ртутные приборы герметичны, поэтому при соблюдении правил эксплуатации они не опасны для окружающей среды.
Коэффициент расширения Hg лежит в основе работы барометров и термометров. В вакуумных насосах и в клапанах высокого давления ртуть используют для герметизации.
Полярограф
Электрохимический анализ веществ проводится на полярографе.
Прибор используют для:
- определения вредных веществ в воздухе;
- диагностике раковых заболеваний;
- анализа содержания тяжелых металлов в материалах;
- изучения химических процессов;
- контроля чистоты медпрепаратов, продуктов.
Для исследования используют два ртутных электрода: поляризующий капельно-ртутный, не поляризующий ртутный. Электроды погружают в раствор, и подают на них напряжение. С помощью гальванометра измеряют величину тока и затем строят полярограмму.
Люминесцентные и кварцевые лампы
Эти лампы представляют собой источник света низкого давления. В обеих лампах электрический разряд проходит через смесь инертного газа и ртутных паров, образуя ультрафиолет.
В люминесцентных лампах герметичная колба, заполненная ртутной смесью, покрыта изнутри люминоформом. Это сделано для того, чтобы перевести невидимое ультрафиолетовое излучение в видимое.
От состава люминоформа получают свет теплого или холодного спектра. Люминесцентные по своей светоотдаче намного эффективнее обыкновенных ламп накаливания, потребляют меньше электроэнергии.
В кварцевых лампах нет люминофоромного покрытия, а колба выполнена из кварцевого стекла. Благодаря этому ультрафиолет попадает напрямую в помещение и дезинфицирует комнату. Воздух в помещении становится стерильным, микробы погибают.
Барометр
Ртутный барометр представляет собой стеклянную, запаянную сверху трубку с ртутью. Нижняя часть трубки помещена в жидкость. Когда атмосферное давление повышается, ртуть поднимается, при понижении давления – опускается. Ртутные барометры считаются наиболее точными.
Электрический аккумулятор
В электрическом аккумуляторе благодаря обратимости химических реакции происходит накопление энергии. Это позволяет использовать их как автономный (резервный) источник тока. Эксплуатационные характеристики зависят от типа электролита и состава электродов.
Ртутный манометр
Наиболее точно измеряет артериальное давление человека ртутный манометр. Воздух с помощью резиновой груши накачивается в стеклянную колбу со ртутью. На трубке нанесена шкала, показывающая величину кровяного давления.
В настоящее время ртутные манометры не производятся, им на смену пришли безопасные механические и электронные.
Термометры
Ртуть изменяет объем в зависимости от температуры. При повышении она увеличивается, при снижении температуры уменьшается соответственно. На этом свойстве и основан принцип работы термометра. Трубочка со ртутью помещается на шкалу с делениями, по которой измеряется температура.
Ртутный диффузионный насос
Применяют такой насос в вакуумных установках. С помощью него откачивают пар, газ из рабочей камеры. Работа такого насоса основана на свойстве ртути изменять давление при изменении температуры. Ртуть периодически нагревают, а затем охлаждают, газ заполняет область с пониженным давлением, образуя вакуум.
Свойства солнечного металла и ртути
Живое серебро представляет собой жидкий металл серебряного цвета со свойственной ему высокой степенью смачивания других металлов. Ртуть имеет тенденцию к скатыванию в шарики, притягивая к себе другие частицы.
Это свойство можно наблюдать в быту в случае повреждения ртутного термометра. Маленькие шарики жидкого компонента устремляются друг к другу и скатываются в большой подвижный шарик.
Ртуть является тяжелым химическим элементом, его удельный вес всего на 6 единиц меньше, чем у золота. Опытные золотодобытчики помещали жидкое серебро в шлюзы, предназначенные для промывки шлихового золота, для улавливания мельчайших частиц и порошка драгоценного металла.
Способ получения амальгамы требует высокой чистоты золота. Оно не должно быть покрыто примесью железа, нефти и других веществ, препятствующих смачиванию.
Чтобы извлечь весь благородный компонент из концентрата, следует его поместить в разбавленный 10 % раствор азотной кислоты. При этом следует подобрать соответствующий сосуд для проведения очистки, чтобы избежать взаимодействия кислой среды с материалом используемой емкости.
Не рекомендуется проводить очистку в лотке. Лучше всего использовать пластиковый лоток или обыкновенную стеклянную банку. Извлечение ртути из амальгамы можно проводить 2 способами:
- нагреванием соединения до полного испарения ртути;
- растворением живого серебра в азотной кислоте.
Температура, при которой ртуть переходит в пар, равна 357°C. Достичь ее можно в верхней части открытого пламени газовых горелок. Нагревание следует проводить в проветриваемом помещении с соблюдением правил техники безопасности, и помнить, что опасно вдыхать пары жидкого химического элемента.
Сферы использования
Применение ртути в современной промышленности соблюдается с большой осторожностью. Перед работой с этим элементом нужно познакомиться с мерами безопасности.. Сферы использования металла:
Сферы использования металла:
- Материал применяется в виде рабочего тела в ртутных термометрах.
- Пары ртути, которые светятся в тлеющем разряде, используются для заполнения люминесцентных ламп.
- Металл и его сплавы применяют в герметичных выключателях, которые включаются в определённом положении.
- Некоторые химические источники тока и гидродинамические подшипники не обходятся без ртути.
- Вещество может применяться в датчиках положения.
- Иодид металла служит полупроводниковым детектором радиоактивного излучения.
- Бромид ртути используется в атомно-водородной энергетике.
- Соединение элемента с цезием выступает высокоэффективным рабочим телом в ионных двигателях.
- Металлическую ртуть используют как катод для электролитического получения активных металлов и щелочей.
- С помощью вещества перерабатывают вторичный алюминий.
- Соли химического элемента широко используют в лабораториях. Они помогают получить ацетальдегид из ацетилена.
- Каломель, сулему и некоторые другие токсичные соединения с Hg применяются в сельском хозяйстве для протравливания зерна и в качестве пестицидов.
В области медицины вещество практически не используют, поскольку оно считается опасным для жизни человека. В виде консерванта он содержится в малых количествах в вакцинах. В прошлом ртуть использовали в качестве слабительного, мочегонного и антисептического средства.
С 2020 года будет запрещено производство некоторых предметов для бытовых нужд, содержащих токсичный металл, поскольку испарения часто вызывают отравления у людей. Также введут регулирование применения вещества и ограничат многие промышленные процессы и отрасли, связанные с этим химическим элементом.
Ртуть — довольно интересный металл, который проявляет необычные свойства. О нём имеется немало занимательных фактов, однако учёные продолжают изучать особенности «жидкого серебра». Возможно, в будущем этому элементу найдут дополнительное применение и смогут снизить степень его токсичности.






























