— бокситы

Бокситы представляют собой смесь минералов, содержащую гидратированный глинозем и примеси; такие как оксиды железа и титана и диоксид кремния со следующими массовыми процентами:
-Для2ИЛИ3 35-60%
-Вера2ИЛИ3 10-30%
-Да2 4-10%
-Дядя2 2-5%
-ЧАС2Или конституции 12-30%.
Глинозем содержится в бокситах в гидратированной форме в двух вариантах:
-моногидраты (Al2ИЛИ3ЧАС2O), которые представлены двумя кристаллографическими формами, боэмитом и диаспором.
-Тригидраты (Al2ИЛИ33H2O), представленный гиббситом.
Бокситы являются основным источником алюминия и поставляют большую часть алюминия, получаемого при добыче полезных ископаемых.
Механические свойства алюминия
Механические свойства алюминия зависят от степени чистоты, вида и режимов его обработки, температуры и других факторов. С возрастанием степени чистоты прочность и твердость алюминия уменьшается, а пластичность возрастает. Модуль упругости при 20°С для металла чистотой 99,25 % составляет 69,65 ГПа, а для электролитически рафинированного алюминия чистотой 99,98 % 65,71 ГПа. С повышением температуры прочность алюминия снижается, а пластичность возрастает. Зависимость механических свойств алюминия от степени его чистоты
| Механические свойства | Степень чистоты алюминия, % | |||||
| 98,0 | 99,0 | 99,5 | 99,996 | 99,0 | ||
| для литого в землю | для литого в кокиль и для отожженного | для деформированого | ||||
| σв, МПа | 88,3 | 83,3 | 73,5 | 49,0 | 88.3 | 137.3 |
| δ, % | 12,5 | 20,0 | 29,0 | 45,0 | 30 | 19 |
| HB | 274,6 | 245,2 | 284,4 | 137,3 | 245,2 | 313,8 |
Влияние температуры на механические свойства отожженной алюминиевой проволоки (0,20 % Si, 0,15 % Fe, следы меди)
| Механические свойства | Температура, °С | |||||||
| 20 | 100 | 200 | 300 | 400 | 500 | 600 | 625 | |
| σв, МПа | 74,4 | 65,3 | 55,0 | 37,3 | 28,4 | 21,3 | 12,2 | 8,3 |
| δ, % | 42,0 | 42,0 | 42,6 | 44,0 | 44,7 | 43,3 | 41,1 | 36,0 |
| φ, % | 94,2 | 94,8 | 95,1 | 96,5 | 98,1 | 99,0 | 99,4 | 99,7 |
При температуре вблизи точки плавления механические свойства загрязненного алюминия могут резко ухудшиться из-за ослабления границ зерен и межкристаллитного разрушения. Температура резкого разупрочнения у литого алюминия чистотой 99,988 % равна 654°С, а чистотой 99,998 % — 656°С.
Алюминий обладает высокой способностью к деформации; его пластичность возрастает с повышением чистоты. Алюминий чистотой 99,995 % можно подвергнуть очень большим вытяжкам, например с диаметра 80 до диаметра 0,1 мм.
При увеличении степени деформации прочность алюминия увеличивается, а удлинение уменьшается
Легирование алюминия высокой степени чистоты повышает его прочность, но понижает его пластичность как при комнатной, так и при пониженных температурах . Например, добавление 0,5 % Fe к алюминию чистотой 99,99 % приводит к повышению σв с 88,3 до 219,7 МПа (нагартованный металл) и с 49,0 до 99,1 МПа (отожженный алюминий).
Источник
Устройство
Радиатор системы отопления схож со своим старшим братом из системы охлаждения. И функции у них схожи, только большой отдаёт тепло в атмосферу, а малый в салон. Оба имеют в своей конструкции два бачка, которые соединены между собой трубками. К трубкам посредством пайки крепятся пластины, увеличивающие площадь охлаждения (чем больше пластин, тем больше теплоотдача)
Поэтому при выборе нужно обращать особое внимание на количество пластин. Сделать это можно, поставив оба экземпляра вместе и визуально осмотрев плотность пластин
У какого радиатора плотность больше, у того и теплоотдача выше. К одному из бачков прикреплены патрубки входа и выхода жидкости. Некоторые модели оборудуются местами для крепления к автомобилю.
Как используют основные свойства алюминия в строительстве
Строительство – одна из основных отраслей-потребителей алюминия. 25 % всего вырабатываемого металла используется именно в ней. Современный облик мегаполисов был бы невозможен без использования алюминия. Он дает возможность создавать функциональные и красивые здания, стремящиеся ввысь. Небоскребы офисных центров имеют фасады из стекла, закрепленные на прочных, легких рамах из алюминия.

Современные торговые, развлекательные и выставочные центры в основе своей имеют каркас из алюминия. Конструкции из данного металла используются для возведения бассейнов, стадионов и других спортивных строений. Алюминий – один из самых востребованных у архитекторов, строителей, дизайнеров металлов. Почему? Давайте разберемся.
Алюминий – прочный и легкий металл, не поддающийся коррозии, имеющий долгий срок службы и совершенно нетоксичный. Он легко поддается обработке, сварке, паянию, его просто сверлить, распиливать, связывать и соединять шурупами. Этот металл способен принять любую форму посредством экструзии. Алюминий поможет воплотить самый смелый замысел архитектора. Из него изготавливаются конструкции, которые невозможно сделать из иных материалов: пластика, дерева или стали.
ЗАПАСЫ И ДОБЫЧА

Кусочки алюминия
По распространённости в земной коре Земли занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14%.
Современный метод получения, процесс Холла—Эру был разработан независимо американцем Чарльзом Холлом и французом Полем Эру в 1886 году. Он заключается в растворении оксида алюминия Al2O3 в расплаве криолита Na3AlF6 с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов. Такой метод получения требует очень больших затрат электроэнергии, и поэтому получил промышленное применение только в XX веке.
История открытия
Свое название серебристо-белый металл получил от латинского языка, в переводе оно означает квасцы. В 1825 году датский физик Ганс Эрстед нагрел амальгаму калия, восстановил хлорид вещества и выделил новый металл. Затем этот эксперимент повторил и улучшил Фридрих Велер. Он применил чистый металлический калий и первый описал химические особенности алюминия.

Полупромышленный способ выделения открыл Сент-Клер Девиль в 1854 году, но он использовал безопасный натрий. Полученный алюминиевый слиток ученый представил на Парижской выставке. А затем он провел еще один эксперимент — электролиз расплава двойной соли хлорида вещества.
До развития технологий алюминий, созданный электролитическим способом из глинозема, был слишком дорогим. Его слиток стоил больше, чем аналогичный кусок золота. Именно поэтому в 1889 году британские ученые подарили Менделееву аналитические весы. Чаши в них были изготовлены из разных металлов — золота и алюминия. В то время в России последнее вещество называли серебром из глины.
Свойства и характеристики
Свойствами металла служат его высокие показатели тепло- и электропроводности, невосприимчивость к коррозии, высокая пластичность и устойчивость к низким температурам. При этом главное его свойство – это небольшая плотность (около 2,7 г/см 3 .).
Механические, технологические, а также физико-химические свойства этого металла имеют непосредственную зависимость от входящих в его состав примесей. К естественным его компонентам относится кремний и железо.
Давайте узнаем далее, какая температура плавления алюминия и его сплавов
Основные параметры
- Плотность алюминия составляет 2,7*10 3 кг/м 3 ;
- Удельный вес — 2,7 г/cм 3 ;
- Температура плавления алюминия 659°C;
- Температура кипения 2000°C;
- Коэффициент линейного расширения составляет — 22,9 *10 6 (1/град).
Теперь рассмотрению подлежат теплопроводность и электропроводность алюминия.
Данное видео сравнивает температуры плавления алюминия и других наиболее часто используемых металлов:
https://youtube.com/watch?v=D5rlsT1GSac
Электропроводность
Важным показателем алюминия является его электропроводность, которая уступает по величине лишь золоту, серебру и меди. Высокий коэффициент электропроводности в сочетании с небольшой плотностью обеспечивает материалу высокую конкурентоспособность в кабельно-проводниковой области.
Помимо основных примесей на этот показатель также влияет титан, марганец и хром. Если алюминий предназначен для производства проводников тока, то суммарное количество примесей не должно превышать 0,01%.
- Показатель электропроводности может варьироваться, в зависимости от состояния, в котором находится алюминий. Процесс длительного отжига увеличивает этот показатель, а нагартовка, напротив, уменьшает его.
- Удельное сопротивление при температуре 20 0 С в зависимости от марки металла находится в пределах 0,0277-0,029 мкОм*м.
Теплопроводность
Коэффициент теплопроводности металла составляет около 0,50 кал/см*с*С и увеличивается со степенью его чистоты.
Это значение меньше, чем у меди и серебра, но больше, чем у остальных металлов. Благодаря ему, алюминий активно используется в производстве теплообменников и радиаторов.
Коррозионная стойкость
Сам металл является химически активным веществом, благодаря чему его используют в алюмотермии. При контакте с воздухом на нем образуется тончайшая пленка из окиси алюминия, которая имеет химическую инертность и высокую прочность. Ее главное назначение – это защищать металл от последующего процесса окисления, а также от воздействия коррозии.
- Если алюминий обладает высокой чистотой, то эта пленка не имеет пор, полностью покрывает его поверхность и обеспечивает надежным сцеплением. В результате металл устойчив не только к воде и воздуху, но и к щелочам и неорганическим кислотам.
- В тех местах, где находятся примеси, защитный слой пленки может быть поврежденным. Такие места становятся уязвимыми для коррозии. Поэтому на поверхности может наблюдаться коррозия точечного типа. Если марка содержит 99,7% алюминия и менее 0,25% железа, скорость коррозии составляет 1.1, при содержании алюминия на 99,0% этот показатель увеличивается до 31.
- Содержащееся железо также уменьшает устойчивость металла к щелочам, но не меняет устойчивость к серной и азотной кислотам.
Взаимодействие с разными веществами
Когда алюминий обладает температурой 100 0 С, он способен взаимодействовать с хлором. Независимо от степени нагрева, алюминий растворяет водород, но при этом не ступает в реакцию с ним. Именно потому он является главным составляющим элементом газов, которые присутствуют в металле.
В целом алюминий устойчив в следующих средах:
- Пресная и морская вода;
- Соли магния, натрия и аммония;
- Серная кислота;
- Слабые растворы из хрома и фосфора;
- Раствор аммиака;
- Уксусная, яблочная и прочие кислоты.
Алюминий не устойчив:
- Раствор из серной кислоты;
- Соляная кислота;
- Едкие щелочи и их раствор;
- Щавелевая кислота.
Про токсичность и экологичность алюминия читайте ниже.
Электропроводность меди и алюминия, а также иные сравнения двух металлов представлены в таблице ниже.
Сравнение характеристик алюминия и меди
Токсичность
Хотя алюминий весьма распространен, но он не используется в метаболизме, ни у одного живого существа. Он обладает незначительным токсическим действием, но многие его неорганические соединения, которые растворяются в воде, способны длительное время пребывать в таком состоянии и негативно сказываться на живых организмах. Наиболее ядовитыми веществами выступают ацетаты, хлориды и нитраты.
Еще больше полезной информации о свойствах алюминия содержит данное видео:
https://youtube.com/watch?v=bsB7WKmKF0k
История открытия
В 16 веке знаменитый Парацельс сделал первый шаг к добыче алюминия. Из квасцов он выделил «квасцовую землю», которая содержала оксид неизвестного тогда металла. В 18 веке к этому эксперименту вернулся немецкий химик Андреас Маргграф. Оксид алюминия он назвал «alumina», что на латинском языке означает «вяжущий». На тот момент металл не пользовался популярностью, так как не был найден в чистом виде. Долгие годы выделить чистый алюминий пытались английские, датские и немецкие учёные. В 1855 году в Париже на Всемирной выставке металл алюминий произвёл фурор. Из него делали только предметы роскоши и ювелирные украшения, так как металл был достаточно дорогим. В конце 19 века появился более современный и дешёвый метод получения алюминия. В 1911 году в Дюрене выпустили первую партию дюралюминия, названного в честь города. В 1919 из этого материала был создан первый самолёт.
Алюминий как химический элемент
- Алюминий является третьим по распространенности – после кислорода и кремния – среди около 90 химических элементов, который обнаружены в земной коре.
- Среди элементов-металлов – он первый.
- Этот металл обладает многими полезными свойствами, физическими, механическими, технологическими — благодаря которым он широко применяется во всех сферах человеческой деятельности.
- Алюминий – это ковкий металл, который имеет серебристо-белый цвет и легко обрабатывается большинством методов обработки металлов давлением: прокаткой, волочением, экструзией (прессованием), ковкой.
- Его плотность – удельный вес – составляет около 2,70 граммов на кубический сантиметр.
- Чистый алюминий плавится при температуре 660 градусов Цельсия.
- Алюминий имеет относительно высокие коэффициенты теплопроводности и электропроводности.
- В присутствии кислорода всегда покрыт тонкой, невидимой пленкой оксида. Эта пленка является в значительной степени непроницаемой и имеет довольно высокие защитные свойства. Поэтому алюминий обычно демонстрирует стабильность и длительный срок службы при нормальных атмосферных условиях.
Алюминиевая проводка
Преимущественное использование легкого металла характерно для зданий постройки 60-х – 70-х годов двадцатого века. Основным критерием выбора серебристого металла называют доступность.
Еще алюминий не случайно называют крылатым металлом. О его небольшой удельной массе известно всем. Но не только это определяет долголетие в использовании этого элемента в электротехнике.
Достоинства
Небольшой вес алюминия используется при прокладке высоковольтных линий. В сравнительном аспекте принята пропорция, когда алюминий на 60 % легче, чем медная токопроводящая шина. Среди прочих достоинств выделяются:
- Невысокая стоимость. Цена играет роль, если учесть протяженность проводки в доме. Только для среднего коттеджа потребуется несколько километров кабеля.
- Химическая стойкость к окислению. Эта особенность актуальна с учетом закрытия стержня пластиковой оплеткой.
- Стойкость открытых участков алюминия. На поверхности металла образована защитная пленка, предохраняющая металл от внешних воздействий.
Незаменим Al и при изготовлении контактов в осветительных установках. Здесь металл вытеснил применявшуюся латунь.
Недостатки
Повсеместное использование алюминия не произошло по причине весомых недостатков, присущих металлу:
- Высокое удельное сопротивление и вытекающая склонность к нагреву. С учетом этого свойства не допускается применять провод сечением менее 16 мм2.
Показатель Al – 0,0271 Ом×мм2/м против аналогичной характеристики у Cu – 0,0175 Ом×мм2/м.
- Подверженность ослаблению металла в местах контакта при сильной нагрузке. Это связано с периодическим нагревом и последующим остыванием места крепления.
- Проблематичность соединения участков алюминиевого кабеля. Препятствием – защитная пленка на поверхности.
- Хрупкость. Даже без периодического нагрева склонна к переломам, в местах изгиба. Ресурс ограничен 25-30 годами.
«Крылатый» металл не оптимальный вариант при прокладке локальных сетей. Его потенциал – передача электроэнергии на большие расстояния.
Примеры решения задач
| Задание | Вычислите плотность по водороду смеси 25 л азота и 175 л кислорода. |
| Решение | Найдем объемные доли веществ в смеси: |
j (N2) = 25 / (25 + 175) = 25 / 200 = 0,125.
j (O2) = 175 / (25 + 175) = 175 / 200 = 0,875.
Объемные доли газов будут совпадать с молярными, т.е. с долями количеств веществ, это следствие из закона Авогадро. Найдем условную молекулярную массу смеси:
Mr conditional (mixture) = 0,125 × 28 + 0,875 × 32 = 3,5 + 28 = 31,5.
Найдем относительную плотность смеси по водороду:
| Ответ | Плотность по водороду смеси, состоящей из азота и кислорода равна 15,75. |
| Задание | Рассчитайте плотности газов водорода H2 и метана CH4 по воздуху. |
| Решение | Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Данная величина показывает, во сколько раз первый газ тяжелее или легче второго газа. |
Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух – это смесь газов.
Таблица теплопроводности материалов на Пли-
| Материал | Плотность, кг/м3 | Теплопроводность, Вт/(м·град) | Теплоемкость, Дж/(кг·град) |
| Плита бумажная прессованая | 600 | 0.07 | — |
| Плита пробковая | 80…500 | 0.043…0.055 | 1850 |
| Плитка облицовочная, кафельная | 2000 | 1.05 | — |
| Плитка термоизоляционная ПМТБ-2 | — | 0.04 | — |
| Плиты алебастровые | — | 0.47 | 750 |
| Плиты из гипса ГОСТ 6428 | 1000…1200 | 0.23…0.35 | 840 |
| Плиты древесно-волокнистые и древесно-стружечные (ГОСТ 4598-74, ГОСТ 10632-77) | 200…1000 | 0.06…0.15 | 2300 |
| Плиты из керзмзито-бетона | 400…600 | 0.23 | — |
| Плиты из полистирол-бетона ГОСТ Р 51263-99 | 200…300 | 0.082 | — |
| Плиты из резольноформальдегидного пенопласта (ГОСТ 20916-75) | 40…100 | 0.038…0.047 | 1680 |
| Плиты из стеклянного штапельного волокна на синтетическом связующем (ГОСТ 10499-78) | 50 | 0.056 | 840 |
| Плиты из ячеистого бетона ГОСТ 5742-76 | 350…400 | 0.093…0.104 | — |
| Плиты камышитовые | 200…300 | 0.06…0.07 | 2300 |
| Плиты кремнезистые | 0.07 | — | |
| Плиты льнокостричные изоляционные | 250 | 0.054 | 2300 |
| Плиты минераловатные на битумной связке марки 200 ГОСТ 10140-80 | 150…200 | 0.058 | — |
| Плиты минераловатные на синтетическом связующем марки 200 ГОСТ 9573-96 | 225 | 0.054 | — |
| Плиты минераловатные на синтетической связке фирмы «Партек» (Финляндия) | 170…230 | 0.042…0.044 | — |
| Плиты минераловатные повышенной жесткости ГОСТ 22950-95 | 200 | 0.052 | 840 |
| Плиты минераловатные повышенной жесткости на органофосфатном связующем (ТУ 21-РСФСР-3-72-76) | 200 | 0.064 | 840 |
| Плиты минераловатные полужесткие на крахмальном связующем | 125…200 | 0.056…0.07 | 840 |
| Плиты минераловатные на синтетическом и битумном связующих | — | 0.048…0.091 | — |
| Плиты мягкие, полужесткие и жесткие минераловатные на синтетическом и битумном связующих (ГОСТ 9573-82, ГОСТ 10140-80, ГОСТ 12394-66) | 50…350 | 0.048…0.091 | 840 |
| Плиты пенопластовые на основе резольных фенолформальдегидных смол ГОСТ 20916-87 | 80…100 | 0.045 | — |
| Плиты пенополистирольные ГОСТ 15588-86 безпрессовые | 30…35 | 0.038 | — |
| Плиты пенополистирольные (экструзионные) ТУ 2244-001-47547616-00 | 32 | 0.029 | — |
| Плиты перлито-битумные ГОСТ 16136-80 | 300 | 0.087 | — |
| Плиты перлито-волокнистые | 150 | 0.05 | — |
| Плиты перлито-фосфогелевые ГОСТ 21500-76 | 250 | 0.076 | — |
| Плиты перлито-1 Пластбетонные ТУ 480-1-145-74 | 150 | 0.044 | — |
| Плиты перлитоцементные | — | 0.08 | — |
| Плиты строительный из пористого бетона | 500…800 | 0.22…0.29 | — |
| Плиты термобитумные теплоизоляционные | 200…300 | 0.065…0.075 | — |
| Плиты торфяные теплоизоляционные (ГОСТ 4861-74) | 200…300 | 0.052…0.064 | 2300 |
| Плиты фибролитовые (ГОСТ 8928-81) и арболит (ГОСТ 19222-84) на портландцементе | 300…800 | 0.07…0.16 | 2300 |
Производство алюминия
До начала позапрошлого века не было достоверной информации о производстве металла. Первые несколько миллиграммов получил Ганс Эрстед в 1825. Через два года Фридрих Велер выделил крупинки, но они моментально покрывались пленкой на воздухе.
До конца XIX столетия вещество не производили в промышленных масштабах. И только в 1854 при финансировании Наполеона III, который надеялся об усилении армии с помощью металла, Сент-Клер Девиль вытеснил алюминий натрием из двойного хлорида натрия. Через год он получил первый слиток массой 6 кг, а до 1890 ученый смог создать более 200 т вещества.
В 1885 году построили первый завод в Гмелингеме, Германия. Технологию для производства разработал Николай Бекетов. Его метод мало отличался от способа Сент-Клер Девиля, но основывался на взаимодействии магния и криолита. За пять лет работы завод создал более 58 т металла, что составило четверть мирового производства.
Эру и Холл практически одновременно изобрели еще один метод — электролиз глинозема. Его растворяли в расплавленном криолите. Он и стал основой современного создания алюминия. В России первый завод появился в 1932 году, тогда промышленность СССР порадовала 47,7 млн т металла. Стимулировала производство Вторая мировая война.
А к 2021 в мире сделали около 59 млн т, лидерами стали:
- Китай;
- РФ;
- Канада;
- США;
- Австралия.
Когда учитывается
При рассмотрении различных свойств материалов часто уделяется внимание и теплопроводности. Этот показатель важен в нижеприведенных случаях:
- Когда нужно отвести тепло от объекта. Тепловая энергия может возникать из-за трения. При этом нагрев становится причиной изменения основных свойств металлов и сплавов: прочности и твердости поверхности. Примером назовем конструкцию двигателя внутреннего сгорания. В процессе хода поршня в блоке цилиндров происходит нагрев основных элементов конструкции. Из-за слишком высокого нагрева даже металлы, устойчивые к воздействию высокой температуры, начинают терять прочность и становятся более пластичными. В результате происходит изменение геометрических размеров важных элементов конструкции, и она выходит из строя. Учитывается теплопроводность и при создании режущего инструмента, обшивки самолетов или высокоскоростных поездов.
- Когда нужно передать тепловую энергию. Центральная система отопления основана на нагреве рабочей среды, которая после подводится к потребителю и происходит передача энергии окружающей среде. Для того чтобы повысить эффективность создаваемой системы трубы, и отопительные радиаторы изготавливаются из металлов, которые способны быстро передавать тепло.
- Когда нужно изолировать поверхность. Встречается ситуация, когда нужно снизить вероятность нагрева поверхности. Для этого применяются специальные материалы, которые обладают высокими изоляционными качествами. Некоторые металлы и сплавы также обладают отражающими свойствами и не нагреваются, а также не передают тепло. Примером назовем фольгу, которая часто применяется в качестве отражающего экрана. Она также изготавливается из тонкого слоя металла, обладающего низким коэффициентом проводимости.
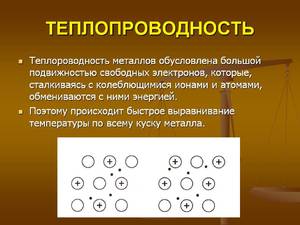 В заключение отметим, что до развития молекулярно-кинетической теории было принято считать передачу тепловой энергии признаком перетекания гипотетического теплорода. Появление современного оборудования позволило изучить строение материалов и изучить поведение частиц при воздействии высокой температуры. Передача энергии происходит за счет быстрого движения молекул, которые начинают сталкиваться, и приводит в движение другие молекулы, находящиеся в спокойном состоянии.
В заключение отметим, что до развития молекулярно-кинетической теории было принято считать передачу тепловой энергии признаком перетекания гипотетического теплорода. Появление современного оборудования позволило изучить строение материалов и изучить поведение частиц при воздействии высокой температуры. Передача энергии происходит за счет быстрого движения молекул, которые начинают сталкиваться, и приводит в движение другие молекулы, находящиеся в спокойном состоянии.
Получение и применение алюминия
Алюминий достаточно трудно выделить из природных соединений химическим способом, что объясняется высокой прочностью связей в оксиде алюминия, поэтому, для промышленного получения алюминия применяют электролиз раствора глинозема Al2O3 в расплавленном криолите Na3AlF6. В результате процесса алюминий выделяется на катоде, на аноде — кислород:
2Al2O3 → 4Al + 3O2
Исходным сырьем служат бокситы. Электролиз протекает при температуре 1000°C: температура плавления оксида алюминия составляет 2500°C — проводить электролиз при такой температуре не представляется возможным, поэтому оксид алюминия растворяют в расплавленном криолите, и уже затем полученный электролит используют при электролизе для получения алюминия.
Применение алюминия:
- алюминиевые сплавы широко применяются в качестве конструкционных материалов в автомобиле-, самолето-, судостроении: дюралюминий, силумин, алюминиевая бронза;
- в химической промышленности в качестве восстановителя;
- в пищевой промышленности для изготовления фольги, посуды, упаковочного материала;
- для изготовления проводов и проч.
Удельный вес
В связи с тем, что медь не является однокомпонентным металлом, расчет его удельного веса своими силами в бытовых условиях затруднен. Как правило, подсчеты осуществляются в соответствующих лабораториях. Но средний диапазон уже давно вычислен и составляет от 8,63 до 8,8 г/см3.
Для упрощения проведения самостоятельных расчетов далее приводим таблицу с данными об удельном весе в соответствии с единицами измерения.
| Материал | Удельный вес (г/см3) | Вес 1 м3 (кг) |
| Медь | От 8,63 до 8,8 | От 8630 до 8800 |
Точные данные используются при подсчете веса необходимого при производстве металлопроката и металлоизделий.
Физические свойства
Металл серебристо-белого цвета, лёгкий, плотность — 2,7 г/см³, температура плавления у технического алюминия — 658 °C, у алюминия высокой чистоты — 660 °C, удельная теплота плавления — 390 кДж/кг, температура кипения — 2500 °C, удельная теплота испарения — 10,53 МДж/кг, временное сопротивление литого алюминия — 10-12 кг/мм², деформируемого — 18-25 кг/мм², сплавов — 38-42 кг/мм².
Твёрдость по Бринеллю — 24-32 кгс/мм², высокая пластичность: у технического — 35 %, у чистого — 50 %, прокатывается в тонкий лист и даже фольгу.
Алюминий обладает высокой электропроводностью и теплопроводностью, 65 % от электропроводности меди, обладает высокой светоотражательной способностью.
Алюминий образует сплавы почти со всеми металлами.
Нахождение в природе
Распространённость
По распространённости в земной коре занимает 1-е место среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Массовая концентрация алюминия в земной коре, по данным различных исследователей, оценивается от 7,45 до 8,14 %.
Природные соединения алюминия
В природе алюминий, в связи с высокой химической активностью, встречается почти исключительно в виде соединений. Некоторые из природных минералов алюминия:
- Бокситы — Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3)
- Нефелины — KNa34
- Алуниты — (Na,K)2SO4·Al2(SO4)3·4Al(OH)3
- Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3)
- Корунд (сапфир, рубин, наждак) — Al2O3
- Полевые шпаты — (K,Na)2O·Al2O3·6SiO2, Ca
- Каолинит — Al2O3·2SiO2 · 2H2O
- Берилл (изумруд, аквамарин) — 3ВеО · Al2О3 · 6SiO2
- Хризоберилл (александрит) — BeAl2O4.
Тем не менее, в некоторых специфических восстановительных условиях (жерла вулканов) найдены ничтожные количества самородного металлического алюминия.
В природных водах алюминий содержится в виде малотоксичных химических соединений, например, фторида алюминия. Вид катиона или аниона зависит, в первую очередь, от кислотности водной среды. Концентрации алюминия в водоёмах России колеблются от 0,001 до 10 мг/л. В морской воде его концентрация 0,01 мг/л.
Изотопы алюминия
Основная статья: Изотопы алюминия
Природный алюминий состоит практически полностью из единственного стабильного изотопа 27Al с ничтожными следами 26Al, наиболее долгоживущего радиоактивного изотопа с периодом полураспада 720 тыс. лет, образующегося в атмосфере при расщеплении ядер аргона 40Arпротонами космических лучей с высокими энергиями.






























